Aminohapot ovat rakennuspalikoita, jotka muodostavat polypeptidejä ja lopulta proteiineja. Näin ollen ne ovat kehomme peruskomponentteja ja elintärkeitä fysiologisille toiminnoille, kuten proteiinisynteesille, kudosten korjaamiselle ja ravinteiden imeytymiselle. Tässä tarkastellaan lähemmin aminohappojen ominaisuuksia, kuinka niitä käytetään elimistössä ja mistä ne tulevat.
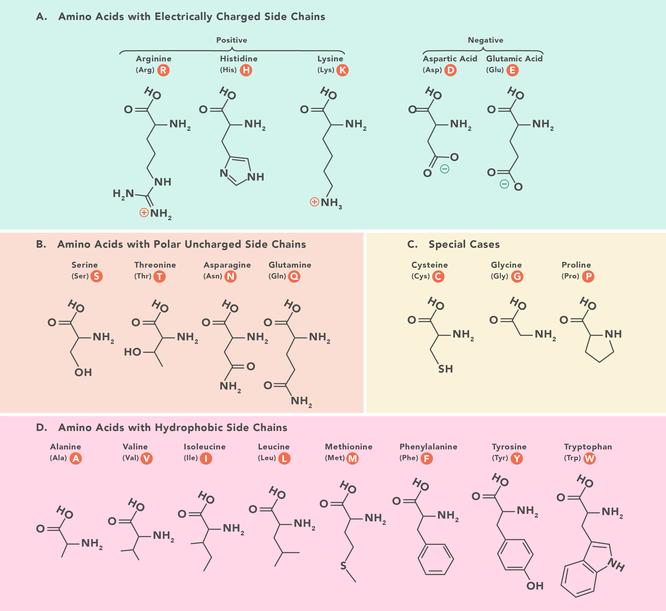
Aminohappokaavio On 20 aminohappoa, jotka muodostavat proteiineja ja kaikilla on sama perusrakenne, jotka eroavat vain R-ryhmän tai sivuketjun suhteen. Yksinkertaisin ja pienin aminohappo on glysiini, jonka R-ryhmä on vety (H). Ne voidaan jakaa alaryhmiin niiden ominaisuuksien mukaan, jotka määräytyvät niillä olevien funktionaalisten ryhmien mukaan. Yleisesti ne jaetaan varauksen, hydrofobisuuden ja napaisuuden mukaan. Nämä ominaisuudet vaikuttavat tapaan, jolla ne ovat vuorovaikutuksessa polypeptidien ja proteiinien ympäröivien aminohappojen kanssa, ja näin ollen vaikuttavat proteiinin 3D-rakenteeseen ja ominaisuuksiin.Tämä kaavio näyttää proteiinien muodostavien 20 aminohapon kemialliset rakenteet.Aminohappolyhenteet
Tässä taulukossa näkyvät 20 aminohaposta käytetyt lyhenteet ja yksikirjaiminen koodit proteiineista löytyviä happoja. Lisäksi pyrrolysiini, jota käytetään proteiinien biosynteesissä joissakin arkeissa ja bakteereissa, mutta jota ei esiinny ihmisissä, ja selenokysteiini, kysteiinianalogi, jota esiintyy vain joissakin suvuissa, sisältyvät siniseen. Lopuksi lyhenteet, joita käytetään aminohappotähteille, joilla on useampi kuin yksi mahdollinen identiteetti, ja lopetuskodoni näytetään punaisella täydentämään yksikirjaimien lyhenteiden aakkosta.
Aminohappo | Lyhenne | Yksikirjaiminen lyhenne |
| alaniini | Ala | A |
| Arginiini | Arg | R |
| Asparagiini | Asn | N |
| asparagiinihappo | Asp | D |
| Kysteiini | Cys | C |
| Glutamiini | Gln | K |
| Glutamiinihappo | Glu | E |
| Glysiini | Gly | G |
| Histidiini | hänen | H |
| Isoleusiini | Ile | I |
| Leusiini | Leu | L |
| Lysiini | Lys | K |
| metioniini | Met | M |
| Fenyylialaniini | Phe | F |
| Proline | Pro | P |
| Seriini | Palvelija | S |
| Treoniini | Thr | T |
| Tryptofaani | Trp | L |
| Tyrosiini | Tyr | Y |
| Valiini | Val | V |
| Pyrrolysiini | Pyl | O |
| Selenokysteiini | sek | U |
| asparagiinihappo tai asparagiini | Asx | B |
|
Glutamiinihappo tai glutamiini | Glx | Z |
| Kaikki aminohapot | Xaa | X |
| Leusiini tai isoleusiini | Xle | J |
| Loppukodoni | TERM |
Ala-aminohappo
Alaniini, joka löydettiin proteiinista vuonna 1875, muodostaa 30 % silkin jäämistä. Sen alhainen reaktiivisuus myötävaikuttaa silkin yksinkertaiseen, pitkänomaiseen rakenteeseen, jossa on vähän ristisidoksia, mikä antaa kuiduille lujuuden, venytyskestävyyden ja joustavuuden. Vain l-stereoisomeeri osallistuu proteiinien biosynteesiin.
Arg-aminohappo
Ihmisissä arginiinia muodostuu proteiinien pilkkoutuessa. Sen jälkeen ihmiskeho voi muuttaa sen typpioksidiksi, kemikaaliksi, jonka tiedetään rentouttavan verisuonia. Verisuonia laajentavan vaikutuksensa vuoksi arginiinia on ehdotettu kroonisen sydämen vajaatoiminnan, korkean kolesterolin, heikentyneen verenkierron ja korkean verenkierron hoitoon. paineita, vaikka näiden alojen tutkimus on edelleen kesken. Arginiinia voidaan valmistaa myös synteettisesti, ja arginiiniin liittyviä yhdisteitä voidaan käyttää maksan vajaatoimintaa sairastavien ihmisten hoidossa, koska se edistää maksan uudistumista. Vaikka arginiini on välttämätön kasvulle, mutta ei kehon ylläpitämiselle, tutkimukset ovat osoittaneet, että arginiini on ratkaisevan tärkeä haavan paranemisprosessissa, erityisesti niillä, joilla on huono verenkierto.
Asn-aminohappo
Vuonna 1806 asparagiini puhdistettiin parsamehusta, joten se oli ensimmäinen aminohappo, joka eristettiin luonnollisesta lähteestä. Kuitenkin vasta vuonna 1932 tiedemiehet pystyivät todistamaan, että asparagiinia esiintyi proteiineissa. Vain l-stereoisomeeri osallistuu nisäkäsproteiinien biosynteesiin. Asparagiini on tärkeä myrkyllisen ammoniakin poistamisessa elimistöstä.
Asp-aminohappo
Asparagiinihappo, joka löydettiin proteiineista vuonna 1868, löytyy yleisesti eläinproteiineista, mutta vain l-stereoisomeeri osallistuu proteiinien biosynteesiin. Tämän aminohapon vesiliukoisuus mahdollistaa entsyymien, kuten pepsiinin, läsnäolon lähellä aktiivisia kohtia.
Cys-aminohappo
Kysteiiniä on erityisen runsaasti karvojen, kavioiden ja ihon keratiinin proteiineissa, koska se on eristetty virtsakivistä vuonna 1810 ja sarvi vuonna 1899. Myöhemmin se syntetisoitiin kemiallisesti ja rakenne selvitettiin 1903–1904. Kysteiinin sivuketjussa oleva rikkipitoinen tioliryhmä on avain sen ominaisuuksiin, mikä mahdollistaa disulfidisiltojen muodostumisen kahden peptidiketjun välille (kuten insuliinin kanssa ) tai silmukan muodostumista yhdessä ketjussa, mikä vaikuttaa lopulliseen proteiinirakenteeseen. Kaksi kysteiinimolekyyliä, jotka on liitetty yhteen disulfidisidoksella, muodostavat kystiiniaminohapon, joka on joskus lueteltu erikseen yleisissä aminohappoluetteloissa. Kysteiiniä valmistetaan kehossa seriinistä ja metioniinista, ja sitä on vain nisäkäsproteiinien l-stereoisomeerissä.
Ihmiset, joilla on geneettinen sairaus kystinuria, eivät pysty imemään kystiiniä tehokkaasti takaisin verenkiertoonsa. Tämän seurauksena korkea kystiinipitoisuus kertyy virtsaan, jossa se kiteytyy ja muodostaa kiviä, jotka tukkivat munuaiset ja virtsarakon.
Gln-aminohappo
Glutamiini eristettiin ensimmäisen kerran juurikasmehusta vuonna 1883, eristettiin proteiinista vuonna 1932 ja syntetisoitiin kemiallisesti seuraavana vuonna. Glutamiini on kehomme runsain aminohappo ja sillä on useita tärkeitä tehtäviä. Ihmisillä glutamiini syntetisoituu glutamiinihaposta ja tämä konversiovaihe on elintärkeä säätelemään elimistössä olevan myrkyllisen ammoniakin määrää, joka muodostaa ureaa ja puriineja.
Glu-aminohappo
Glutamiinihappo eristettiin vehnägluteenista vuonna 1866 ja syntetisoitiin kemiallisesti vuonna 1890. Yleisesti eläinproteiineissa esiintyy vain l-stereoisomeeriä nisäkäsproteiineissa. , jonka ihmiset pystyvät syntetisoimaan tavallisesta välituotteesta α-ketoglutaarihaposta. L-glutamiinihapon mononatriumsuolaa, mononatriumglutamaattia (MSG) käytetään yleisesti mausteena ja arominvahventeena. Glutamiinihapon karboksyylisivuketju pystyy toimimaan elimistölle myrkyllisen ammoniakin luovuttajana ja vastaanottajana mahdollistaen ammoniakin turvallisen kuljetuksen maksaan, jossa se muuttuu ureaksi ja erittyy munuaisten kautta. Vapaa glutamiinihappo voi myös hajota hiilidioksidiksi ja vedeksi tai muuttua sokereiksi.
Gly-aminohappo
Glysiini oli ensimmäinen aminohappo, joka eristettiin proteiinista, tässä tapauksessa gelatiini, ja se on ainoa, joka ei ole optisesti aktiivinen (ei d- tai l-stereoisomeerejä). Se on rakenteellisesti yksinkertaisin α-aminohapoista, ja se on hyvin reagoimaton, kun se liitetään proteiineihin. Silti glysiini on tärkeä seriinin aminohapon, glutationin koentsyymin, puriinien ja hemoglobiinin tärkeän osan biosynteesissä.
Hänen aminohapponsa
Histidiini eristettiin vuonna 1896 ja sen rakenne vahvistettiin kemiallisella synteesillä vuonna 1911. Histidiini on histamiinin suora esiaste ja myös tärkeä hiilen lähde puriinisynteesissä. Kun histidiinin sivuketju liitetään proteiineihin, se voi toimia protonin vastaanottajana ja luovuttajana ja välittää tärkeitä ominaisuuksia yhdistettynä entsyymeihin, kuten kymotrypsiineihin ja hiilihydraattien, proteiinien ja nukleiinihappojen aineenvaihduntaan osallistuviin entsyymeihin. Imeväisille histidiiniä pidetään välttämättömänä aminohappo, aikuiset voivat olla lyhyitä aikoja ilman ravinnon saantia, mutta sitä pidetään silti välttämättömänä.
Ile-aminohappo
Isoleusiini eristettiin juurikassokerimelassista vuonna 1904. Isoleusiinipuolen hydrofobinen luonne Ketju on tärkeä määritettäessä proteiinien tertiääristä rakennetta, johon se sisältyy. Harvinaisesta perinnöllisestä sairaudesta, vaahterasiirappivirtsataudista kärsivillä on viallinen entsyymi isoleusiinille, leusiinille ja valiinille yhteisessä hajoamisreitissä. Ilman hoitoa aineenvaihduntatuotteet kerääntyvät potilaan virtsaan, mikä edistää erottuvaa hajua, joka antaa tilalle nimen.
Leu-aminohappo
Leusiini eristettiin juustosta vuonna 1819 ja lihaksista ja villasta kiteisessä tilassaan vuonna 1820. Vuonna 1891 se syntetisoitiin laboratoriossa. Ainoastaan l-stereoisomeeri esiintyy nisäkäsproteiinissa ja se voidaan hajottaa yksinkertaisemmiksi yhdisteiksi kehon entsyymeillä. Jotkut DNA:ta sitovat proteiinit sisältävät alueita, joissa leusiinit on järjestetty konfiguraatioihin, joita kutsutaan leusiinivetoketjuiksi.
Lys-aminohappo
Lysiini eristettiin ensimmäisen kerran maitoproteiinikaseiinista vuonna 1889, ja sen rakenne selvitettiin vuonna 1902. Lysiini on tärkeä entsyymien sitoutumisessa koentsyymeihin ja sillä on tärkeä rooli histonien toiminnassa. Monissa viljakasveissa on hyvin vähän lysiiniä, mikä on johtanut puutteisiin joissakin populaatioissa, jotka ovat voimakkaasti riippuvaisia niistä ravinnonsaannissa sekä kasvissyöjille ja vähärasvaisille laihduttajille. Tästä johtuen on pyritty kehittämään runsaasti lysiiniä sisältäviä maissikantoja.
Met-aminohappo
Metioniini eristettiin maitoproteiinikaseiinista vuonna 1922 ja sen rakenne selvitettiin laboratoriosynteesillä vuonna 1928. Metioniini on tärkeä rikin lähde monille kehon yhdisteille, mukaan lukien kysteiini ja tauriini. Rikkipitoisuutensa ansiosta metioniini auttaa estämään rasvan kertymistä maksaan ja auttaa puhdistamaan aineenvaihdunnan jätteitä ja myrkkyjä. Metioniini on ainoa välttämätön aminohappo, jota ei ole läsnä merkittävissä määrissä soijapapuja, ja siksi sitä tuotetaan kaupallisesti ja lisätään moniin soijajauhotuotteet.
Phe-aminohappo
Fenyylialaniini eristettiin ensimmäisen kerran luonnollisesta lähteestä (lupiinin ituista) vuonna 1879 ja myöhemmin syntetisoitiin kemiallisesti vuonna 1882. Ihmiskeho pystyy tavallisesti hajottamaan fenyylialaniinin tyrosiiniksi, mutta yksilöillä, joilla on perinnöllinen sairaus fenyyliketonuria (PKU), tämän muuntamisen suorittavalla entsyymillä ei ole aktiivisuutta. Jos fenyylialaniinia ei hoideta, se kerääntyy vereen, mikä hidastaa lasten henkistä kehitystä. Noin 10 000 lapsesta syntyy sairaus, ja vähäfenyylialaniinipitoisen ruokavalion noudattaminen varhaisessa iässä voi helpottaa vaikutuksia.
Pro-aminohappo
Vuonna 1900 proliini syntetisoitiin kemiallisesti. Seuraavana vuonna se eristettiin maitoproteiinikaseiinista ja sen rakenne osoitettiin olevan sama. Ihminen voi syntetisoida proliinia glutamiinihaposta, joka esiintyy vain l-stereoisomeerinä nisäkäsproteiineissa. Kun proliinia liitetään proteiineihin, sen erikoinen rakenne johtaa jyrkkään mutkiin tai mutkeihin peptidiketjussa, mikä myötävaikuttaa suuresti proteiinin lopulliseen rakenteeseen. Proliini ja sen johdannainen hydroksiproliini muodostavat 21 % sidekudokselle välttämättömän kuituproteiinin kollageenin aminohappojäännöksistä.
Ser-aminohappo
Seriini eristettiin ensimmäisen kerran silkkiproteiinista vuonna 1865, mutta sen rakennetta ei selvitetty vuoteen 1902 asti. Ihminen voi syntetisoida seriiniä muista metaboliiteista, mukaan lukien glysiinistä, vaikka vain l-stereoisomeeri esiintyy nisäkäsproteiineissa. Seriini on tärkeä monien aineenvaihduntatuotteiden biosynteesille, ja se on usein tärkeä entsyymien, joihin se sisältyy, katalyyttiselle toiminnalle, mukaan lukien kymotrypsiini ja trypsiini. Hermokaasut ja jotkin hyönteismyrkyt toimivat yhdistymällä seriinijäännökseen asetyylikoliiniesteraasin aktiivisessa kohdassa, estää entsyymin kokonaan. Esteraasiaktiivisuus on välttämätöntä hermovälittäjäaineen asetyylikoliinin hajottamiseksi, muuten vaarallisen korkeita tasoja kertyy, mikä johtaa nopeasti kouristukseen ja kuolemaan.
Thr-aminohappo
Treoniini eristettiin fibriinistä vuonna 1935 ja syntetisoitiin samana vuonna. Vain l-stereoisomeeri esiintyy nisäkäsproteiineissa, joissa se on suhteellisen reagoimaton. Vaikka se on tärkeä monissa bakteerireaktioissa, sen metabolinen rooli korkeammissa eläimissä, mukaan lukien ihmiset, jää epäselväksi.
Trp-aminohappo
Kaseiinista (maitoproteiinista) vuonna 1901 eristetty tryptofaanin rakenne perustettiin vuonna 1907 , mutta vain l-stereoisomeeri esiintyy nisäkäsproteiineissa. Ihmisen suolistossa bakteerit hajottavat ravinnon tryptofaania vapauttaen yhdisteitä, kuten skatolia ja indolia, jotka antavat ulosteille epämiellyttävän aromin. Tryptofaani muuttuu B3-vitamiiniksi (kutsutaan myös nikotiinihapoksi tai niasiiniksi), mutta ei riittävällä nopeudella pitämään meidät terveinä. Tästä johtuen meidän on myös nautittava B3-vitamiinia, mikä johtaa puutostilaan nimeltä pellagra.
Tyr-aminohappo
Vuonna 1846 tyrosiini eristettiin kaseiinin (juuston proteiinin) hajoamisesta ), jonka jälkeen se syntetisoitiin laboratoriossa ja sen rakenne määritettiin vuonna 1883. Ihminen voi syntetisoida tyrosiinia fenyylialaniinista vain l-stereoisomeerinä nisäkäsproteiineissa. Tyrosiini on tärkeä esiaste lisämunuaisen hormoneille epinefriinille ja norepinefriinille, kilpirauhashormoneille, mukaan lukien tyroksiinille, sekä hiusten ja ihon pigmentille melaniinille. Entsyymeissä tyrosiinitähteet yhdistetään usein aktiivisiin kohtiin, joiden muuttaminen voi muuttaa entsyymispesifisyyttä tai pyyhkiä aktiivisuuden kokonaan pois. Vakavasta geneettisestä tilasta fenyyliketonuriasta (PKU) kärsivät eivät pysty muuttamaan fenyylialaniinia tyrosiiniksi, kun taas alkaptonuriapotilailla on vikaa. tyrosiiniaineenvaihduntaa, jolloin muodostuu erottuva virtsa, joka tummuu joutuessaan alttiiksi ilmalle.
Val-aminohappo
Valiinin rakenne perustettiin vuonna 1906 sen jälkeen, kun se eristettiin ensimmäisen kerran albumiinista vuonna 1879. Vain l-stereoisomeeri esiintyy nisäkäsproteiinissa. Valiini voi hajota elimistössä yksinkertaisemmiksi yhdisteiksi, mutta ihmisillä, joilla on harvinainen geneettinen sairaus, vaahterasiirappivirtsatauti, viallinen entsyymi keskeyttää tämän prosessin ja voi johtaa kuolemaan, jos sitä ei hoideta.
Karboksyyliryhmän ominaisuudet
Hydrofobisten aminohappojen ominaisuudetPolaristen aminohappojen ominaisuudet
Aromaattisten aminohappojen ominaisuudet
Proteiinisynteesin määritelmä ja aminohappokoodi
Proteiinin muodostamiseksi aminohapot polymeroidaan muodostaen peptidisidos, joka alkaa N-päästä ja päättyy C-päähän.
Yhdeksän välttämätöntä aminohappoa ja aminohappolisäaine
Ihmiskeho pystyy syntetisoimaan 11 aminohaposta 20:stä, mutta emme pysty syntetisoimaan yhdeksää muuta. Tämä johtuu todennäköisesti geenien katoamisesta tai mutaatiosta ajan mittaan vasteena muuttuviin selektiivisiin paineisiin, kuten tiettyjä aminohappoja sisältävien elintarvikkeiden runsauttamiseen. Näitä kutsutaan siksi välttämättömiksi aminohapoiksi, ja ne on hankittava ruokavaliomme kautta. Tietyt eläinlajit pystyvät syntetisoimaan erilaisia aminohappoja ja vastaavasti niiden ravinnontarpeet vaihtelevat. Ihminen esimerkiksi kykenee syntetisoimaan arginiinia, mutta koirat ja kissat eivät – se on hankittava ravinnon kautta. Toisin kuin ihmiset ja koirat, kissat eivät pysty syntetisoimaan tauriinia. Tämä on yksi syy siihen, että kaupallinen koiranruoka ei sovellu kissoille. Ihmisille yhdeksän aminohappoa, jotka on hankittava ruokavaliolla, ovat histidiini, isoleusiini, leusiini, lysiini, metioniini, fenyylialaniini, treoniini, tryptofaani ja valiini.
Ruokia, jotka sisältävät kaikki yhdeksän välttämätöntä aminohappoa, kutsutaan "täydellisiksi proteiineiksi", ja niihin kuuluvat liha, äyriäiset, munat, maitotuotteet, soija, kvinoa ja tattari. Muut proteiinilähteet, kuten pähkinät, siemenet, jyvät ja pavut, sisältävät joitakin, mutta eivät kaikkia välttämättömiä aminohappoja, ja siksi niitä kutsutaan epätäydellisiksi.
Tässä taulukossa näkyvät Yhdysvaltojen suositellut päivittäiset annokset yhdeksän välttämättömän aminohapon painokiloa kohden.
| Aminohappo | Suositeltu päiväannos (mg/kg ruumiinpainoa) |
| Histidiini | 14 |
| Isoleusiini | 19 |
| Leusiini | 42 |
| Lysiini | 38 |
| Metioniini | 19 |
| Fenyylialaniini | 33 |
| Treoniini | 20 |
| Tryptofaani | 5 |
| Valiini | 24 |
Puhutaanpa lisäravinteista. Kaikki kehosi välttämättömät aminohappotarpeet voidaan tyydyttää terveellisellä ja tasapainoisella ruokavaliolla. On kuitenkin olemassa joitain kannattajia korkean pitoisuuden lisäravinteiden ottamiseksi parantamaan tekijöitä, kuten mielialaa, unta, harjoitussuoritusta, painonpudotusta ja estämään lihasten menetystä. Katso monilta "terveys ja hyvinvointi" -sivuilta ja siellä on ihmisiä, jotka kauppaavat aminohappolisäravinteiden etuja, mutta onko olemassa hyviä todisteita tämän tueksi?
Tärkeää aminohappoa tryptofaania tarvitaan serotoniinin tuotantoon. Se on välittäjäaine, jolla on tärkeä rooli unessa, mielialassa ja käyttäytymisessä. Tämän seurauksena tryptofaanitasojen manipuloinnin vaikutuksia uneen ja mielialaan on tutkittu useissa tutkimuksissa. Vaikka on näyttöä siitä, että tryptofaanitasojen heikkeneminen voi vaikuttaa negatiivisesti uneen ja mielialaan, monet tutkimukset kärsivät pienistä otoskooista, riittävien kontrollien puutteesta tai muista puutteista. Näin ollen, vaikka se on selvästi avaintekijä ruokavaliossa ja lisäravinnolla saattaa olla myönteisiä vaikutuksia, tällä hetkellä ei ole todisteita, jotka tukevat tryptofaanin antamista terveellisessä ruokavaliossa nautittavan lisäksi, ja lisätutkimuksia tarvitaan. .
Vaikka jotkut tutkimukset viittaavat siihen, että aminohappolisäravinteet voivat vaikuttaa positiivisesti harjoitussuoritukseen joissakin ryhmissä, tulokset vaihtelevat suuresti tutkimusten välillä, ja monet tutkimukset osoittavat vain vähän tai ei ollenkaan hyötyä. Kliinisessä tutkimuksessa tarkastellaan myös aminohapporavintolisän ottamisen vaikutuksia ihon valon ikääntymiseen, mutta tuloksia ei vielä paljasteta.