Аминокиселините са градивните елементи, които образуват полипептиди и в крайна сметка протеини. Следователно те са основни компоненти на нашите тела и са жизненоважни за физиологичните функции като синтез на протеини, възстановяване на тъканите и усвояване на хранителни вещества. Тук разглеждаме по-отблизо свойствата на аминокиселините, как се използват в тялото и откъде идват.
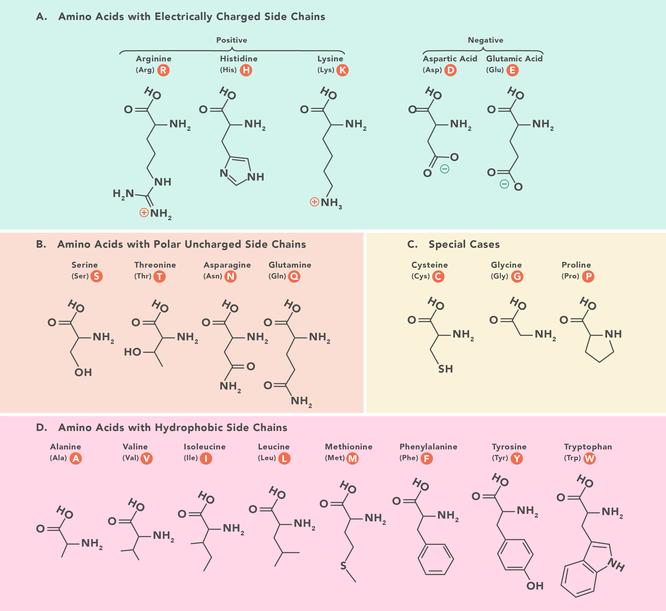
Диаграма на аминокиселините Има 20 аминокиселини, които изграждат протеините и всички имат една и съща основна структура, като се различават само по R-групата или страничната верига, която имат. Най-простата и най-малка аминокиселина е глицинът, за който R-групата е водород (Н). Те могат да бъдат подразделени според техните свойства, продиктувани от функционалните групи, които притежават. Най-общо те се разделят по заряд, хидрофобност и полярност. Тези свойства влияят върху начина, по който взаимодействат със заобикалящите ги аминокиселини в полипептиди и протеини, и следователно влияят върху 3D структурата и свойствата на протеина.Тази диаграма показва химичните структури на 20-те аминокиселини, които изграждат протеините.Съкращения на аминокиселините
Тази таблица показва съкращенията и еднобуквените кодове, използвани за 20-те аминокиселини киселини, открити в протеините. В допълнение, пиролизинът, използван в биосинтезата на протеини в някои археи и бактерии, но не присъстващ при хората, и селеноцистеинът, цистеинов аналог, открит само в някои линии, са включени в синьо. И накрая, съкращенията, използвани за аминокиселинни остатъци с повече от една потенциална идентичност, и терминиращият кодон са показани в червено, за да се завърши азбуката на еднобуквените съкращения.
Аминокиселина | Съкращение | Съкращение от една буква |
| Аланин | Ала | A |
| Аргинин | Arg | R |
| Аспаргин | Asn | N |
| Аспаргинова киселина | Asp | D |
| Цистеин | Cys | C |
| Глутамин | Gln | Q |
| Глутаминова киселина | Glu | E |
| Глицин | Гли | G |
| Хистидин | Неговият | H |
| Изолевцин | Ил | Аз |
| Левцин | лея | L |
| Лизин | Lys | K |
| Метионин | Мет | M |
| Фенилаланин | Phe | F |
| Пролин | Pro | P |
| Серин | Сер | S |
| Треонин | Чет | T |
| Триптофан | Trp | W |
| Тирозин | Тир | Y |
| Валин | Ст. | V |
| Пиролизин | Пил | O |
| Селеноцистеин | Сек | U |
| Аспаргинова киселина или аспарагин | Asx | B |
|
Глутаминова киселина или глутамин | Glx | Z |
| Всяка аминокиселина | Xaa | X |
| Левцин или изолевцин | Xle | J |
| Терминиращ кодон | СРОК |
Ала аминокиселина
Открит в протеина през 1875 г., аланинът съставлява 30% от остатъците в коприната. Неговата ниска реактивност допринася за простата, удължена структура на коприната с малко напречни връзки, което придава на влакната здравина, устойчивост на разтягане и гъвкавост. Само l-стереоизомерът участва в биосинтезата на протеините.
Arg аминокиселина
При хората аргининът се произвежда, когато протеините се усвояват. След това може да бъде преобразуван в азотен оксид от човешкото тяло, химикал, за който е известно, че отпуска кръвоносните съдове. Поради своите вазодилататорни ефекти, аргининът е предложен за лечение на хора с хронична сърдечна недостатъчност, висок холестерол, компрометирана циркулация и високо кръвно натиск, въпреки че изследванията на тези фронтове все още продължават. Аргининът може да се произвежда и синтетично, а съединенията, свързани с аргинина, могат да се използват при лечение на хора с чернодробна дисфункция поради ролята му в насърчаването на регенерацията на черния дроб. Въпреки че аргининът е необходим за растежа, но не и за поддържането на тялото, изследванията показват, че аргининът е от решаващо значение за процеса на зарастване на рани, особено при тези с лошо кръвообращение.
Аминокиселина Asn
През 1806 г. аспарагинът е пречистен от сок от аспержи, което го прави първата аминокиселина, изолирана от естествен източник. Въпреки това, едва през 1932 г. учените успяха да докажат, че аспарагинът се съдържа в протеините. Само l-стереоизомерът участва в биосинтезата на протеините на бозайниците. Аспарагинът е важен за отстраняването на токсичния амоняк от тялото.
Asp аминокиселина
Открита в протеините през 1868 г., аспарагиновата киселина се среща често в животинските протеини, но само l-стереоизомерът участва в биосинтезата на протеините. Водоразтворимостта на тази аминокиселина се поддава на присъствието близо до активните центрове на ензими като пепсин.
Аминокиселина Cys
Цистеинът е особено изобилен в протеините на косата, копитата и кератина на кожата, като е изолиран от пикочен камък през 1810 г. и от рог през 1899 г. Впоследствие той е химически синтезиран и структурата е разгадана през 1903-4. Съдържащата сяра тиолова група в страничната верига на цистеина е ключова за неговите свойства, позволявайки образуването на дисулфидни мостове между две пептидни вериги (както при инсулина ) или образуване на бримка в рамките на една верига, което влияе на крайната протеинова структура. Две цистеинови молекули, свързани помежду си чрез дисулфидна връзка, образуват аминокиселината цистин, която понякога е изброена отделно в общите списъци на аминокиселини. Цистеинът се произвежда в тялото от серин и метионин и присъства само в l-стереоизомера в протеините на бозайниците.
Хората с генетично заболяване цистинурия не са в състояние ефективно да реабсорбират цистин в кръвта си. Следователно високи нива на цистин се натрупват в урината им, където кристализира и образува камъни, които блокират бъбреците и пикочния мехур.
Gln аминокиселина
Глутаминът е изолиран за първи път от сок от цвекло през 1883 г., изолиран от протеин през 1932 г. и впоследствие синтезиран химически през следващата година. Глутаминът е най-разпространената аминокиселина в нашите тела и изпълнява няколко важни функции. При хората глутаминът се синтезира от глутаминова киселина и тази стъпка на преобразуване е жизненоважна за регулиране на нивото на токсичния амоняк в тялото, образувайки урея и пурини.
Glu аминокиселина
Глутаминовата киселина е изолирана от пшеничен глутен през 1866 г. и химически синтезирана през 1890 г. Често срещана в животинските протеини, само l-стереоизомерът се среща в протеините на бозайници , които хората са в състояние да синтезират от обикновения междинен продукт α-кетоглутарова киселина. Мононатриевата сол на 1-глутаминова киселина, мононатриевият глутамат (MSG) обикновено се използва като подправка и подобрител на вкуса. Карбоксилната странична верига на глутаминовата киселина е в състояние да действа като донор и акцептор на амоняка, който е токсичен за тялото, което позволява безопасното транспортиране на амоняка до черния дроб, където той се превръща в урея и се екскретира от бъбреците. Свободната глутаминова киселина също може да се разгради до въглероден диоксид и вода или да се трансформира в захари.
Аминокиселина Gly
Глицинът е първата аминокиселина, изолирана от протеин, в този случай желатин и е единственият, който не е оптически активен (няма d- или l-стереоизомери). Структурно най-простата от α-аминокиселините, тя е много нереактивна, когато се включи в протеини. Въпреки това глицинът е важен в биосинтезата на аминокиселината серин, коензима глутатион, пурините и хема, жизненоважна част от хемоглобина.
Неговата аминокиселина
Хистидинът е изолиран през 1896 г. и структурата му е потвърдена чрез химичен синтез през 1911 г. Хистидинът е директният прекурсор на хистамина и също е важен източник на въглерод в синтеза на пурин. Когато е включена в протеини, страничната верига на хистидина може да действа като протонен акцептор и донор, предавайки важни свойства, когато се комбинира в ензими като химотрипсин и тези, участващи в метаболизма на въглехидрати, протеини и нуклеинови киселини. За кърмачетата хистидинът се счита за основен аминокиселина, възрастните могат да издържат за кратки периоди без хранителен прием, но все пак се счита за необходима.
Ile аминокиселина
Изолевцинът е изолиран от меласа от захарно цвекло през 1904 г. Хидрофобната природа на изолевциновата страна веригата е важна при определянето на третичната структура на протеините, в които е включена. Тези, които страдат от рядко наследствено заболяване, наречено заболяване на урината от кленов сироп, имат дефектен ензим в пътя на разграждане, общ за изолевцин, левцин и валин. Без лечение метаболитите се натрупват в урината на пациента, допринасяйки за отличителната миризма, която дава името на състоянието.
Аминокиселина лев
Левцинът е изолиран от сирене през 1819 г. и от мускули и вълна в кристално състояние през 1820 г. През 1891 г. той е синтезиран в лаборатория. Само l-стереоизомерът се появява в протеина на бозайниците и може да бъде разграден до по-прости съединения от ензимите на тялото. Някои ДНК свързващи протеини съдържат региони, в които левцините са подредени в конфигурации, наречени левцинови ципове.
Аминокиселина Lys
Лизинът е изолиран за първи път от млечния протеин казеин през 1889 г. и неговата структура е изяснена през 1902 г. Лизинът е важен за свързването на ензимите с коензимите и играе важна роля в начина, по който функционират хистоните. Много зърнени култури са с много ниско съдържание на лизин, което е довело до дефицити в някои популации, които разчитат в голяма степен на тях за храна, както и при вегетарианци и диети с ниско съдържание на мазнини. Следователно са положени усилия за разработване на царевични сортове, богати на лизин.
Аминокиселина Met
Метионинът е изолиран от млечния протеин казеин през 1922 г. и неговата структура е разгадана чрез лабораторен синтез през 1928 г. Метионинът е важен източник на сяра за множество съединения в тялото, включително цистеин и таурин. Свързан със съдържанието на сяра, метионинът помага да се предотврати натрупването на мазнини в черния дроб и помага за детоксикацията на метаболитни отпадъци и токсини. Метионинът е единствената незаменима аминокиселина, която не присъства в значителни количества соя и следователно се произвежда в търговската мрежа и се добавя към много продукти от соев шрот.
Phe аминокиселина
Фенилаланинът е изолиран за първи път от естествен източник (кълнове от лупина) през 1879 г. и впоследствие синтезиран химически през 1882 г. Човешкото тяло обикновено е в състояние да разгради фенилаланина до тирозин, но при индивиди с наследствено заболяване фенилкетонурия (PKU), ензимът, който извършва това преобразуване, няма активност. Ако не се лекува, фенилаланинът се натрупва в кръвта, което води до забавено умствено развитие при децата. На всеки 10 000 деца се раждат с това състояние, приемането на диета с ниско съдържание на фенилаланин в ранна възраст може да облекчи ефектите.
Про аминокиселина
През 1900 г. пролинът е синтезиран химически. На следващата година той беше изолиран от млечния протеин казеин и структурата му се оказа същата. Хората могат да синтезират пролин от глутаминова киселина, появяващ се само като l-стереоизомер в протеини на бозайници. Когато пролинът е включен в протеините, неговата особена структура води до остри завои или прегъвания в пептидната верига, което допринася значително за крайната структура на протеина. Пролинът и неговият производен хидроксипролин представляват 21% от аминокиселинните остатъци на фиброзния протеин колаген, който е от съществено значение за съединителната тъкан.
Ser аминокиселина
Серинът е изолиран за първи път от копринен протеин през 1865 г., но структурата му не е установена до 1902 г. Хората могат да синтезират серин от други метаболити, включително глицин, въпреки че само l-стереоизомерът се появява в протеините на бозайниците. Серинът е важен за биосинтезата на много метаболити и често е важен за каталитичната функция на ензимите, в които е включен, включително химотрипсин и трипсин. Нервните газове и някои инсектициди действат чрез комбиниране със серинови остатъци в активното място на ацетилхолин естераза, пълно инхибиране на ензима. Естеразната активност е от съществено значение за разграждането на невротрансмитера ацетилхолин, в противен случай се натрупват опасно високи нива, бързо водещи до конвулсии и смърт.
Аминокиселина Thr
Треонинът е изолиран от фибрин през 1935 г. и е синтезиран през същата година. Само l-стереоизомерът се появява в протеини на бозайници, където е относително нереактивен. Въпреки че е важен в много реакции при бактериите, метаболитната му роля при висшите животни, включително хората, остава неясна.
Trp аминокиселина
Изолирана от казеин (млечен протеин) през 1901 г., структурата на триптофана е установена през 1907 г. , но само l-стереоизомерът се появява в протеините на бозайниците. В червата на човека бактериите разграждат хранителния триптофан, освобождавайки съединения като скатол и индол, които придават неприятния аромат на изпражненията. Триптофанът се превръща във витамин B3 (наричан още никотинова киселина или ниацин), но не с достатъчна скорост, за да ни поддържа здрави. Следователно ние също трябва да приемаме витамин В3, липсата на това води до дефицит, наречен пелагра.
Аминокиселина Tyr
През 1846 г. тирозинът е изолиран от разграждането на казеина (протеин от сирене ), след което е синтезиран в лабораторията и структурата му е определена през 1883 г. Присъстващ само в l-стереоизомера в протеини на бозайници, хората могат да синтезират тирозин от фенилаланин. Тирозинът е важен предшественик на надбъбречните хормони епинефрин и норепинефрин, хормоните на щитовидната жлеза, включително тироксин и пигмента на косата и кожата меланин. В ензимите тирозиновите остатъци често се свързват с активни места, промяната на които може да промени специфичността на ензима или да унищожи изцяло активността. Страдащите от сериозно генетично заболяване фенилкетонурия (PKU) не са в състояние да превърнат фенилаланина в тирозин, докато пациентите с алкаптонурия имат дефектен метаболизъм на тирозин, произвеждащ отличителна урина, която потъмнява, когато е изложена на въздух.
Аминокиселина Val
Структурата на валина е установена през 1906 г., след като за първи път е изолиран от албумин през 1879. Само l-стереоизомерът се появява в протеина на бозайниците. Валинът може да се разгради в по-прости съединения в тялото, но при хора с рядко генетично заболяване, наречено болест на урината с кленов сироп, дефектен ензим прекъсва този процес и може да се окаже фатален, ако не се лекува.
Свойства на карбоксилната група
Свойства на хидрофобните аминокиселиниСвойства на полярните аминокиселини
Свойства на ароматните аминокиселини
Дефиниция на протеинов синтез и кодът на аминокиселината
За да се образува протеин, аминокиселините се полимеризират с образуването на пептидна връзка, започваща от N-края и завършваща при С-края.
Девет незаменими аминокиселини и аминокиселинни добавки
Човешкото тяло е в състояние да синтезира 11 от 20-те аминокиселини, но останалите девет не можем. Това вероятно е резултат от загуба на ген или мутация с течение на времето в отговор на променящ се селективен натиск, като например изобилието от определена храна, съдържаща специфични аминокиселини. Следователно те се наричат есенциални аминокиселини и трябва да се набавят чрез нашата диета. Определени животински видове са способни да синтезират различни аминокиселини и съответно техните диетични изисквания се различават. Хората например могат да синтезират аргинин, но кучетата и котките не могат – те трябва да го набавят чрез прием с храна. За разлика от хората и кучетата, котките не могат да синтезират таурин. Това е една от причините търговската кучешка храна да не е подходяща за котки. За хората деветте аминокиселини, които трябва да се набавят чрез диета, са хистидин, изолевцин, левцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Храните, които съдържат всичките девет основни аминокиселини, се наричат „пълни протеини“ и включват месо, морски дарове, яйца, млечни продукти, соя, киноа и елда. Други източници на протеини, като ядки, семена, зърнени храни и боб, съдържат някои, но не всички незаменими аминокиселини и затова се наричат непълни.
Тази таблица показва препоръчителните дневни дози на 1 kg телесно тегло в Съединените щати за деветте основни аминокиселини.
| Аминокиселина | Препоръчителни дневни дози (mg/kg телесно тегло) |
| Хистидин | 14 |
| Изолевцин | 19 |
| Левцин | 42 |
| Лизин | 38 |
| Метионин | 19 |
| Фенилаланин | 33 |
| Треонин | 20 |
| Триптофан | 5 |
| Валин | 24 |
Нека поговорим за добавките. Всички нужди на тялото ви от основни аминокиселини могат да бъдат задоволени чрез здравословна, балансирана диета. Въпреки това, има някои защитници на приемането на добавки с висока концентрация за подобряване на фактори като настроение, сън, изпълнение на упражнения, загуба на тегло и предотвратяване на загуба на мускули. Погледнете на много страници за „здраве и благополучие“ и има хора, които търгуват с предимствата на добавките с аминокиселини, но има ли добри доказателства в подкрепа на това?
Есенциалната аминокиселина триптофан е необходима за производството на серотонин, невротрансмитер с важна роля в съня, настроението и поведението. Следователно ефектите от манипулирането на нивата на триптофан върху съня и настроението са изследвани в редица проучвания. Въпреки че има доказателства, че изчерпването на нивата на триптофан може да повлияе отрицателно на съня и настроението, много проучвания страдат от малък размер на извадката, липса на достатъчно контрол или други недостатъци. Следователно, въпреки че е ясно ключов компонент в диетата и може да има потенциал добавките да имат благоприятен ефект, доказателства в подкрепа на прилагането на триптофан над и отвъд това, което може да се консумира в здравословна диета, в момента липсват и е необходимо допълнително проучване .
Въпреки че има някои проучвания, които предполагат, че приемането на добавки с аминокиселини може да има положителен ефект върху изпълнението на упражненията в някои групи, резултатите варират значително между проучванията, като много проучвания показват малка или никаква полза. Клинично изпитване също разглежда последиците от приема на аминокиселинна хранителна добавка върху фотостареенето на кожата, но резултатите все още не са разкрити.