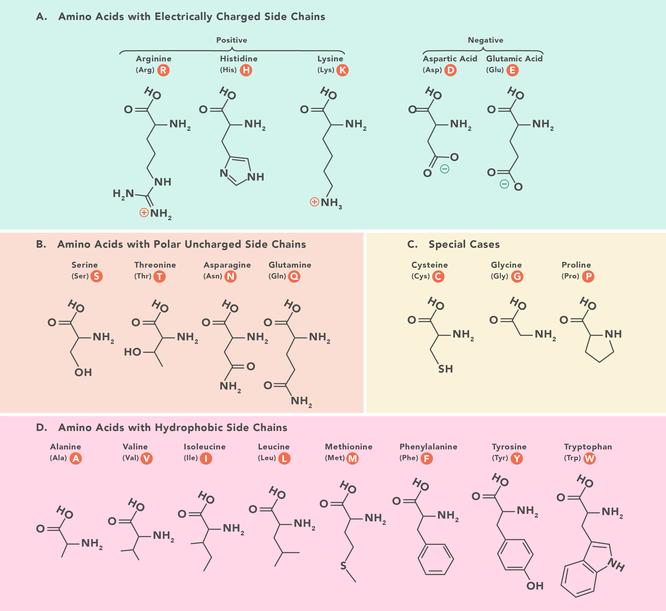
Les acides aminés sont les éléments constitutifs qui forment les polypeptides et finalement les protéines. Par conséquent, ce sont des composants fondamentaux de notre corps et vitaux pour les fonctions physiologiques telles que la synthèse des protéines, la réparation des tissus et l'absorption des nutriments. Ici, nous examinons de plus près les propriétés des acides aminés, comment ils sont utilisés dans le corps et d'où ils viennent.
Tableau des acides aminés Il y a 20 acides aminés qui composent les protéines et tous ont la même structure de base, ne différant que par le groupe R ou la chaîne latérale qu'ils ont. L'acide aminé le plus simple et le plus petit est la glycine dont le groupe R est un hydrogène (H). Ils peuvent être subdivisés selon leurs propriétés, dictées par les groupes fonctionnels qu'ils possèdent. En gros, ils sont divisés par charge, hydrophobicité et polarité. Ces propriétés influencent la façon dont ils interagissent avec les acides aminés environnants dans les polypeptides et les protéines, et par conséquent ont un impact sur la structure et les propriétés 3D des protéines.Ce tableau montre les structures chimiques des 20 acides aminés qui composent les protéines.Abréviations des acides aminés
Ce tableau montre les abréviations et les codes à une seule lettre utilisés pour les 20 acides aminés acides présents dans les protéines. De plus, la pyrrolysine , utilisée dans la biosynthèse des protéines chez certaines archées et bactéries mais non présente chez l'homme, et la sélénocystéine , un analogue de la cystéine que l'on ne trouve que dans certaines lignées, sont incluses en bleu. Enfin, les abréviations utilisées pour les résidus d'acides aminés avec plus d'une identité potentielle et le codon de terminaison sont indiqués en rouge pour compléter l'alphabet des abréviations à une seule lettre.
acide aminé | Abréviation | Abréviation à une seule lettre |
| Alanine | Ala | A |
| Arginine | Arg | R |
| Asparagine | Asn | N |
| Acide aspartique | Aspic | D |
| Cystéine | Cys | C |
| Glutamine | Gln | Q |
| Acide glutamique | Glu | E |
| Glycine | Gly | G |
| Histidine | Son | H |
| Isoleucine | Ile | Je |
| Leucine | Leu | L |
| Lysine | Lys | K |
| Méthionine | Atteint | M |
| Phénylalanine | Phe | F |
| Proline | Pro | P |
| Sérine | Ser | S |
| Thréonine | Thr | T |
| Tryptophane | Trp | W |
| Tyrosine | Tyr | O |
| Valine | Valeur | V |
| Pyrrolysine | Pyl | O |
| Sélénocystéine | Sec | U |
| Acide aspartique ou asparagine | Asx | B |
|
Acide glutamique ou glutamine | Glx | Z |
| Tout acide aminé | Xaa | X |
| Leucine ou Isoleucine | Xle | J |
| Codon de terminaison | TERME |
Ala aminoacide
Découverte dans les protéines en 1875, l'alanine représente 30 % des résidus de la soie. Sa faible réactivité contribue à la structure simple et allongée de la soie avec peu de réticulations qui confère aux fibres force, résistance à l'étirement et flexibilité. Seul le stéréoisomère l participe à la biosynthèse des protéines.
Acide aminé Arg
Chez l'homme, l'arginine est produite lors de la digestion des protéines. Il peut ensuite être converti en oxyde nitrique par le corps humain, un produit chimique connu pour détendre les vaisseaux sanguins. En raison de ses effets vasodilatateurs, l'arginine a été proposée pour le traitement des personnes souffrant d'insuffisance cardiaque chronique, d'hypercholestérolémie, de circulation compromise et d'hypertension artérielle. pression, bien que la recherche sur ces fronts soit toujours en cours. L'arginine peut également être produite synthétiquement, et les composés apparentés à l'arginine peuvent être utilisés dans le traitement des personnes atteintes d'un dysfonctionnement hépatique en raison de son rôle dans la promotion de la régénération du foie. Bien que l'arginine soit nécessaire à la croissance mais pas à l'entretien du corps, la recherche a indiqué que l'arginine est cruciale pour le processus de cicatrisation, en particulier chez les personnes ayant une mauvaise circulation.
Asn amino acid
En 1806, l'asparagine a été purifiée à partir du jus d'asperge, ce qui en fait le premier acide aminé à être isolé d'une source naturelle. Cependant, ce n'est qu'en 1932 que les scientifiques ont pu prouver que l'asparagine était présente dans les protéines. Seul le stéréoisomère l participe à la biosynthèse des protéines de mammifères. L'asparagine est importante dans l'élimination de l'ammoniac toxique du corps.
Acide aminé asp
Découvert dans les protéines en 1868, l'acide aspartique est couramment présent dans les protéines animales, mais seul le stéréoisomère L participe à la biosynthèse des protéines. La solubilité dans l'eau de cet acide aminé se prête à la présence à proximité des sites actifs d'enzymes telles que la pepsine.
Acide aminé Cys
La cystéine est particulièrement abondante dans les protéines des cheveux, des sabots et de la kératine de la peau, ayant été isolée d'un calcul urinaire en 1810 et de corne en 1899. Par la suite, il a été synthétisé chimiquement et la structure a été résolue en 1903–4. Le groupe thiol contenant du soufre dans la chaîne latérale de la cystéine est la clé de ses propriétés, permettant la formation de ponts disulfure entre deux chaînes peptidiques (comme avec l'insuline ) ou la formation de boucles au sein d'une seule chaîne, impactant la structure finale de la protéine. Deux molécules de cystéine liées entre elles par une liaison disulfure constituent l'acide aminé cystine, qui est parfois répertorié séparément dans les listes d'acides aminés courantes. La cystéine est fabriquée dans le corps à partir de la sérine et de la méthionine et n'est présente que dans le stéréoisomère L des protéines de mammifères.
Les personnes atteintes de la maladie génétique cystinurie sont incapables de réabsorber efficacement la cystine dans leur circulation sanguine. Par conséquent, des niveaux élevés de cystine s'accumulent dans leur urine où elle se cristallise et forme des calculs qui bloquent les reins et la vessie.
Acide aminé Gln
La glutamine a été isolée pour la première fois du jus de betterave en 1883, isolée d'une protéine en 1932 et ensuite synthétisée chimiquement l'année suivante. La glutamine est l'acide aminé le plus abondant dans notre corps et remplit plusieurs fonctions importantes. Chez l'homme, la glutamine est synthétisée à partir de l'acide glutamique et cette étape de conversion est d'une importance vitale pour réguler le niveau d'ammoniac toxique dans le corps, formant de l'urée et des purines.
Glu amino acide
L'acide glutamique a été isolé du gluten de blé en 1866 et synthétisé chimiquement en 1890. Communément présent dans les protéines animales, seul le stéréoisomère L est présent dans les protéines de mammifères , que les humains sont capables de synthétiser à partir de l'acide α-cétoglutarique intermédiaire commun. Le sel monosodique de l'acide l-glutamique, le glutamate monosodique (MSG) est couramment utilisé comme condiment et exhausteur de goût. La chaîne latérale carboxyle de l'acide glutamique est capable d'agir en tant que donneur et accepteur d'ammoniac, qui est toxique pour le corps, permettant le transport sûr de l'ammoniac vers le foie où il est converti en urée et excrété par les reins. L'acide glutamique libre peut également être dégradé en dioxyde de carbone et en eau ou transformé en sucres.
Acide aminé Gly
La glycine a été le premier acide aminé à être isolé d'une protéine, dans ce cas gélatine, et est le seul qui n'est pas optiquement actif (pas de stéréoisomères d ou l). Structurellement le plus simple des acides α-aminés, il est très peu réactif lorsqu'il est incorporé dans des protéines. Même ainsi, la glycine est importante dans la biosynthèse de l'acide aminé sérine, du coenzyme glutathion, des purines et de l'hème, une partie vitale de l'hémoglobine.
Son acide aminé
L'histidine a été isolée en 1896 et sa structure a été confirmée par synthèse chimique en 1911. L'histidine est le précurseur direct de l'histamine et est également une source importante de carbone dans la synthèse des purines. Lorsqu'elle est incorporée dans des protéines, la chaîne latérale de l'histidine peut agir comme un accepteur et un donneur de protons, véhiculant des propriétés importantes lorsqu'elle est combinée à des enzymes telles que la chymotrypsine et celles impliquées dans le métabolisme des glucides, des protéines et des acides nucléiques. Pour les nourrissons, l'histidine est considérée comme un élément essentiel acide aminé, les adultes sont capables de passer de courtes périodes sans apport alimentaire mais sont toujours considérés comme essentiels.
Acide aminé Ile
L'isoleucine a été isolée de la mélasse de sucre de betterave en 1904. La nature hydrophobe du côté de l'isoleucine La chaîne est importante pour déterminer la structure tertiaire des protéines dans lesquelles elle est incluse. Les personnes souffrant d'une maladie héréditaire rare appelée maladie urinaire du sirop d'érable ont une enzyme défectueuse dans la voie de dégradation commune à l'isoleucine, la leucine et la valine. Sans traitement, les métabolites s'accumulent dans l'urine du patient, contribuant à l'odeur distinctive qui donne son nom à la maladie.
Acide aminé Leu
La leucine a été isolée du fromage en 1819 et du muscle et de la laine à l'état cristallin en 1820. En 1891, il a été synthétisé en laboratoire. Seul le stéréoisomère l apparaît dans les protéines de mammifères et peut être dégradé en composés plus simples par les enzymes du corps. Certaines protéines de liaison à l'ADN contiennent des régions dans lesquelles les leucines sont disposées dans des configurations appelées fermetures à glissière à leucine.
Acide aminé Lys
La lysine a été isolée pour la première fois de la caséine protéique du lait en 1889, et sa structure a été élucidée en 1902. La lysine est importante dans la liaison des enzymes aux coenzymes et joue un rôle important dans le fonctionnement des histones. De nombreuses cultures céréalières sont très pauvres en lysine, ce qui a entraîné des carences chez certaines populations qui en dépendent fortement pour se nourrir ainsi que chez les végétariens et les régimes faibles en gras. Par conséquent, des efforts ont été faits pour développer des souches de maïs riches en lysine.
Acide aminé Met
La méthionine a été isolée de la caséine protéique du lait en 1922, et sa structure a été résolue par synthèse en laboratoire en 1928. La méthionine est une source importante de soufre pour de nombreux composés dans le corps, y compris la cystéine et la taurine. Liée à sa teneur en soufre, la méthionine aide à prévenir l'accumulation de graisse dans le foie et aide à détoxifier les déchets métaboliques et les toxines. La méthionine est le seul acide aminé essentiel qui n'est pas présent dans des quantités importantes de soja et est donc produit commercialement et ajouté à de nombreux produits à base de farine de soja.
Acide aminé Phe
La phénylalanine a été isolée pour la première fois à partir d'une source naturelle (pousses de lupin) en 1879 et par la suite synthétisé chimiquement en 1882. Le corps humain est généralement capable de décomposer la phénylalanine en tyrosine, mais chez les personnes atteintes de la maladie héréditaire phénylcétonurie (PCU), l'enzyme qui effectue cette conversion manque d'activité. Si elle n'est pas traitée, la phénylalanine s'accumule dans le sang, provoquant un retard de développement mental chez les enfants. Sur 10 000 enfants naissent avec la maladie, l'adoption précoce d'un régime pauvre en phénylalanine peut en atténuer les effets.
Pro acide aminé
En 1900, la proline a été synthétisée chimiquement. L'année suivante, il a ensuite été isolé de la caséine protéique du lait et sa structure s'est avérée la même. Les humains peuvent synthétiser la proline à partir de l'acide glutamique, n'apparaissant que sous la forme du stéréoisomère l dans les protéines de mammifères. Lorsque la proline est incorporée dans les protéines, sa structure particulière entraîne des courbures ou des plis prononcés dans la chaîne peptidique, contribuant grandement à la structure finale de la protéine. La proline et son dérivé hydroxyproline représentent 21 % des résidus d'acides aminés de la protéine fibreuse collagène, essentielle au tissu conjonctif.
Acide aminé Ser
La sérine a été isolée pour la première fois de la protéine de soie en 1865, mais sa structure n'a pas été établie jusqu'en 1902. Les humains peuvent synthétiser la sérine à partir d'autres métabolites, dont la glycine, bien que seul le stéréoisomère l apparaisse dans les protéines de mammifères. La sérine est importante pour la biosynthèse de nombreux métabolites et est souvent importante pour la fonction catalytique des enzymes dans lesquelles elle est incorporée, y compris la chymotrypsine et la trypsine. Les gaz neurotoxiques et certains insecticides agissent en se combinant avec un résidu de sérine dans le site actif de l'acétylcholine estérase, inhibant complètement l'enzyme. L'activité estérase est essentielle pour décomposer le neurotransmetteur acétylcholine, sinon des niveaux dangereusement élevés s'accumulent, entraînant rapidement des convulsions et la mort.
L'acide aminé Thr
La thréonine a été isolée de la fibrine en 1935 et synthétisée la même année. Seul le stéréoisomère l apparaît dans les protéines de mammifères où il est relativement peu réactif. Bien qu'important dans de nombreuses réactions chez les bactéries, son rôle métabolique chez les animaux supérieurs, y compris les humains, reste incertain.
Acide aminé Trp
Isolé de la caséine (protéine du lait) en 1901, la structure du tryptophane a été établie en 1907 , mais seul le stéréoisomère l apparaît dans les protéines de mammifères. Dans l'intestin humain, les bactéries décomposent le tryptophane alimentaire, libérant des composés comme le scatole et l'indole qui donnent aux matières fécales leur arôme désagréable. Le tryptophane est converti en vitamine B3 (également appelée acide nicotinique ou niacine), mais pas à un taux suffisant pour nous maintenir en bonne santé. Par conséquent, nous devons également ingérer de la vitamine B3, faute de quoi cela entraîne une carence appelée pellagre.
Acide aminé Tyr
En 1846, la tyrosine a été isolée de la dégradation de la caséine (une protéine du fromage ), à la suite de quoi il a été synthétisé en laboratoire et sa structure déterminée en 1883. Seul présent dans le stéréoisomère l des protéines de mammifères, l'homme peut synthétiser la tyrosine à partir de la phénylalanine. La tyrosine est un précurseur important des hormones surrénales épinéphrine et norépinéphrine, des hormones thyroïdiennes, y compris la thyroxine et de la mélanine, pigment des cheveux et de la peau. Dans les enzymes, les résidus de tyrosine sont souvent associés à des sites actifs, dont l'altération peut modifier la spécificité de l'enzyme ou anéantir complètement l'activité. métabolisme de la tyrosine, produisant une urine distincte qui s'assombrit lorsqu'elle est exposée à l'air.
Val acide aminé
La structure de la valine a été établie en 1906, après avoir d'abord été isolée de l'albumine dans 1879. Seul le stéréoisomère l apparaît dans la protéine de mammifère. La valine peut être dégradée en composés plus simples dans le corps, mais chez les personnes atteintes d'une maladie génétique rare appelée maladie urinaire du sirop d'érable, une enzyme défectueuse interrompt ce processus et peut s'avérer mortelle si elle n'est pas traitée.
Propriétés du groupe carboxyle
Propriétés des acides aminés hydrophobesPropriétés des acides aminés polaires
Propriétés des acides aminés aromatiques
Définition de la synthèse des protéines et le code des acides aminés
Pour former une protéine, les acides aminés sont polymérisés avec la formation d'une liaison peptidique, commençant à l'extrémité N-terminale et se terminant à l'extrémité C-terminale.
Neuf acides aminés essentiels et suppléments d'acides aminés
Le corps humain est capable de synthétiser 11 des 20 acides aminés, mais nous ne pouvons pas les neuf autres. Cela est probablement dû à la perte ou à la mutation de gènes au fil du temps en réponse à des pressions sélectives changeantes, telles que l'abondance d'aliments particuliers contenant des acides aminés spécifiques. Ceux-ci sont donc appelés acides aminés essentiels et doivent être acquis par notre alimentation. Certaines espèces animales sont capables de synthétiser différents acides aminés et, par conséquent, leurs besoins alimentaires diffèrent. Les humains, par exemple, sont capables de synthétiser l'arginine, mais les chiens et les chats ne le peuvent pas - ils doivent l'acquérir par l'apport alimentaire. Contrairement aux humains et aux chiens, les chats sont incapables de synthétiser la taurine. C'est l'une des raisons pour lesquelles les aliments pour chiens commerciaux ne conviennent pas aux chats. Pour les humains, les neuf acides aminés qui doivent être acquis par l'alimentation sont l'histidine, l'isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane et la valine.
Les aliments qui contiennent les neuf acides aminés essentiels sont appelés "protéines complètes" et comprennent la viande, les fruits de mer, les œufs, les produits laitiers, le soja, le quinoa et le sarrasin. D'autres sources de protéines, telles que les noix, les graines, les céréales et les haricots, contiennent certains acides aminés essentiels, mais pas tous, et sont donc qualifiées d'incomplètes.
Ce tableau indique les apports journaliers recommandés aux États-Unis pour 1 kg de poids corporel pour les neuf acides aminés essentiels.
| Acide aminé | Apports journaliers recommandés (mg/kg de poids corporel) |
| Histidine | 14 |
| Isoleucine | 19 |
| Leucine | 42 |
| Lysine | 38 |
| Méthionine | 19 |
| Phénylalanine | 33 |
| Thréonine | 20 |
| Tryptophane | 5 |
| Valine | 24 |
Parlons des suppléments. Tous les besoins en acides aminés essentiels de votre corps peuvent être satisfaits par une alimentation saine et équilibrée. Cependant, certains préconisent la prise de suppléments à haute concentration pour améliorer des facteurs tels que l'humeur, le sommeil, les performances physiques, la perte de poids et prévenir la perte musculaire. Regardez sur de nombreuses pages "santé et bien-être" et il y a des gens qui colportent les avantages des suppléments d'acides aminés, mais y a-t-il de bonnes preuves pour étayer cela ?
Le tryptophane, un acide aminé essentiel, est nécessaire à la production de sérotonine, un neurotransmetteur jouant un rôle important dans le sommeil, l'humeur et le comportement. Par conséquent, les effets de la manipulation des niveaux de tryptophane sur le sommeil et l'humeur ont été étudiés dans un certain nombre d'études. Bien qu'il soit prouvé que l'épuisement des niveaux de tryptophane peut avoir un impact négatif sur le sommeil et l'humeur, de nombreuses études souffrent de petites tailles d'échantillons, d'un manque de contrôles suffisants ou d'autres défauts. Par conséquent, bien qu'il s'agisse clairement d'un élément clé de l'alimentation et que la supplémentation puisse avoir des effets bénéfiques, les preuves à l'appui de l'administration de tryptophane au-delà de ce qui peut être consommé dans le cadre d'une alimentation saine font actuellement défaut et une enquête plus approfondie est nécessaire. .
Bien que certaines études suggèrent que la prise de suppléments d'acides aminés peut avoir des effets positifs sur la performance physique dans certains groupes, les résultats varient considérablement d'une étude à l'autre, de nombreuses études démontrant peu ou pas d'avantages. Un essai clinique se penche également sur les conséquences de la prise d'un complément alimentaire d'acides aminés sur le photovieillissement cutané mais les résultats ne sont pas encore dévoilés.