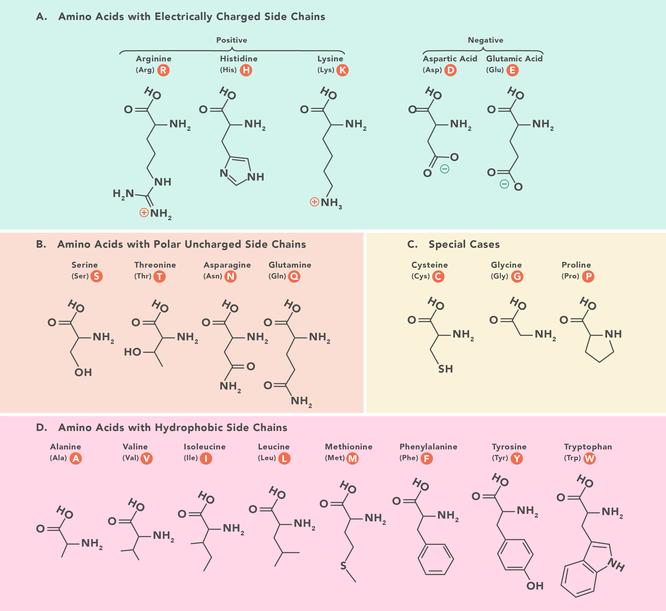
Aminokyseliny jsou stavební kameny, které tvoří polypeptidy a nakonec bílkoviny. V důsledku toho jsou základními složkami našeho těla a jsou životně důležité pro fyziologické funkce, jako je syntéza proteinů, obnova tkání a vstřebávání živin. Zde se blíže podíváme na vlastnosti aminokyselin, jak jsou v těle využívány a odkud pocházejí.
Tabulka aminokyselin Existuje 20 aminokyselin, které tvoří proteiny a všechny mají stejnou základní strukturu, liší se pouze skupinou R nebo postranním řetězcem, které mají. Nejjednodušší a nejmenší aminokyselinou je glycin, jehož R-skupina je vodík (H). Mohou být dále rozděleny podle jejich vlastností, diktovaných funkčními skupinami, které mají. Široce se dělí podle náboje, hydrofobnosti a polarity. Tyto vlastnosti ovlivňují způsob, jakým interagují s okolními aminokyselinami v polypeptidech a proteinech, a následně ovlivňují 3D strukturu a vlastnosti proteinu.Tato tabulka ukazuje chemické struktury 20 aminokyselin, které tvoří proteiny.Zkratky aminokyselin
Tato tabulka ukazuje zkratky a jednopísmenné kódy používané pro 20 aminokyselin. kyseliny nacházející se v bílkovinách. Kromě toho jsou modře zahrnuty pyrrolysin, který se používá při biosyntéze proteinů u některých archaea a bakterií, ale není přítomen u lidí, a selenocystein, cysteinový analog, který se vyskytuje pouze v některých liniích. Nakonec jsou zkratky používané pro aminokyselinové zbytky s více než jednou potenciální identitou a terminační kodon zobrazeny červeně, aby se dokončila abeceda jednopísmenných zkratek.
Aminokyselina | Zkratka | Jednopísmenná zkratka |
| Alanin | Ala | A |
| Arginin | Arg | R |
| Asparagin | Asn | N |
| Kyselina asparagová | Asp | D |
| Cystein | Cys | C |
| Glutamin | Gln | O |
| Kyselina glutamová | Glu | E |
| Glycin | Gly | G |
| Histidin | Jeho | V |
| Isoleucin | Ile | Já |
| Leucin | Leu | L |
| Lyzina | Lys | K |
| Methionin | Splněno | M |
| Fenylalanin | Phe | F |
| Proline | Pro | P |
| Serin | Ser | S |
| Threonin | Thr | T |
| Tryptofan | Trp | W |
| Tyrosin | Tyr | Y |
| Valine | Val | V |
| Pyrrolysin | Pyl | O |
| Selenocystein | Sec | U |
| Kyselina asparagová nebo asparagin | Asx | B |
|
Kyselina glutamová nebo glutamin | Glx | Z |
| Jakákoli aminokyselina | Xaa | X |
| Leucin nebo isoleucin | Xle | J |
| Terminační kodon | TERM |
Ala aminokyselina
Alanin, který byl objeven v proteinu v roce 1875, tvoří 30 % zbytků v hedvábí. Jeho nízká reaktivita přispívá k jednoduché, protáhlé struktuře hedvábí s malým množstvím příčných vazeb, což dává vláknům pevnost, odolnost proti roztažení a pružnost. Biosyntézy proteinů se účastní pouze l-stereoisomer.
Aminokyselina Arg
U lidí se arginin vyrábí při trávení bílkovin. Lidské tělo jej pak může přeměnit na oxid dusnatý, chemickou látku, o které je známo, že uvolňuje krevní cévy. Kvůli svým vazodilatačním účinkům byl arginin navržen pro léčbu lidí s chronickým srdečním selháním, vysokým cholesterolem, narušeným krevním oběhem a vysokým krevním tlakem. tlak, ačkoli výzkum na těchto frontách stále probíhá. Arginin lze také vyrobit synteticky a sloučeniny příbuzné argininu lze použít při léčbě lidí s dysfunkcí jater kvůli jeho roli při podpoře regenerace jater. Ačkoli je arginin nezbytný pro růst, ale ne pro udržení těla, výzkum ukázal, že arginin je zásadní pro proces hojení ran, zejména u pacientů se špatnou cirkulací.
Aminokyselina Asn
V roce 1806 byl asparagin vyčištěn z chřestové šťávy, čímž se stal první aminokyselinou, která byla izolována z přírodního zdroje. Nicméně až v roce 1932 byli vědci schopni prokázat, že se asparagin vyskytoval v proteinech. Biosyntézy savčích proteinů se účastní pouze l-stereoisomer. Asparagin je důležitý při odstraňování toxického amoniaku z těla.
Asp aminokyselina
Kyselina asparagová, objevená v proteinech v roce 1868, se běžně vyskytuje v živočišných bílkovinách, avšak pouze l-stereoisomer se účastní biosyntézy bílkovin. Rozpustnost této aminokyseliny ve vodě se hodí k přítomnosti v blízkosti aktivních míst enzymů, jako je pepsin.
Aminokyselina Cys
Cystein je zvláště hojný v proteinech vlasů, kopyt a keratinu kůže, protože byl izolován z močového kamene v roce 1810 az rohu v roce 1899. Následně byl chemicky syntetizován a struktura vyřešena v letech 1903–4. Pro jeho vlastnosti je klíčová thiolová skupina obsahující síru v postranním řetězci cysteinu, která umožňuje tvorbu disulfidových můstků mezi dvěma peptidovými řetězci (jako u inzulínu ) nebo tvorba smyček v rámci jednoho řetězce, ovlivňující konečnou proteinovou strukturu. Dvě cysteinové molekuly spojené dohromady disulfidovou vazbou tvoří aminokyselinu cystin, která je někdy uvedena samostatně v běžných seznamech aminokyselin. Cystein se v těle vyrábí ze serinu a methioninu a je přítomen pouze v l-stereoizomeru v savčích proteinech.
Lidé s genetickým onemocněním cystinurie nejsou schopni účinně reabsorbovat cystin do krevního oběhu. V důsledku toho se vysoké hladiny cystinu hromadí v jejich moči, kde krystalizuje a tvoří kameny, které blokují ledviny a močový měchýř.
Gln aminokyselina
Glutamin byl poprvé izolován z řepné šťávy v roce 1883, izolován z proteinu v roce 1932 a následně chemicky syntetizován následující rok. Glutamin je nejhojnější aminokyselina v našem těle a plní několik důležitých funkcí. U lidí je glutamin syntetizován z kyseliny glutamové a tento krok přeměny je životně důležitý při regulaci hladiny toxického amoniaku v těle, při tvorbě močoviny a purinů.
Glu aminokyselina
Kyselina glutamová byla izolována z pšeničného lepku v roce 1866 a chemicky syntetizována v roce 1890. Běžně se vyskytuje v živočišných bílkovinách, pouze l-stereoizomer se vyskytuje v savčích bílkovinách , kterou jsou lidé schopni syntetizovat z běžného meziproduktu kyseliny α-ketoglutarové. Monosodná sůl kyseliny l-glutamové, glutamát sodný (MSG) se běžně používá jako koření a zvýrazňovač chuti. Karboxylový postranní řetězec kyseliny glutamové je schopen působit jako donor a příjemce amoniaku, který je pro tělo toxický, umožňuje bezpečný transport amoniaku do jater, kde se přemění na močovinu a vyloučí se ledvinami. Volná kyselina glutamová může být také degradována na oxid uhličitý a vodu nebo přeměněna na cukry.
Gly aminokyselina
Glycin byl první aminokyselinou, která byla izolována z proteinu, v tomto případě želatina a je jediná, která není opticky aktivní (žádné d- nebo l-stereoizomery). Strukturálně nejjednodušší z α-aminokyselin, je velmi nereaktivní, když je začleněna do proteinů. I tak je glycin důležitý při biosyntéze aminokyseliny serinu, koenzymu glutathionu, purinů a hemu, životně důležité součásti hemoglobinu.
Jeho aminokyselina
Histidin byl izolován v roce 1896 a jeho struktura byla potvrzena chemickou syntézou v roce 1911. Histidin je přímým prekurzorem histaminu a je také důležitým zdrojem uhlíku při syntéze purinů. Když je histidin začleněn do proteinů, může postranní řetězec histidinu působit jako akceptor a donor protonů, přenášející důležité vlastnosti, když jsou kombinovány do enzymů, jako je chymotrypsin a těch, které se podílejí na metabolismu sacharidů, proteinů a nukleových kyselin. Pro kojence je histidin považován za nezbytný aminokyseliny jsou dospělí schopni vydržet po krátkou dobu bez dietního příjmu, ale je stále považován za nezbytný.
Ile aminokyselina
Isoleucin byl izolován z melasy řepného cukru v roce 1904. Hydrofobní povaha isoleucinové strany Řetězec je důležitý při určování terciární struktury proteinů, ve kterých je obsažen. Ti, kteří trpí vzácnou dědičnou poruchou zvanou onemocnění moči javorovým sirupem, mají vadný enzym v degradační dráze společné pro isoleucin, leucin a valin. Bez léčby se v moči pacienta hromadí metabolity, které přispívají k výraznému zápachu, který dává tomuto stavu jméno.
Leu aminokyselina
Leucin byl izolován ze sýra v roce 1819 a ze svaloviny a vlny v krystalickém stavu v roce 1820. V roce 1891 byl syntetizován v laboratoři. V savčí bílkovině se objevuje pouze l-stereoizomer, který může být enzymy těla rozkládán na jednodušší sloučeniny. Některé proteiny vázající DNA obsahují oblasti, ve kterých jsou leuciny uspořádány do konfigurací nazývaných leucinové zipy.
Aminokyselina Lys
Lysin byl poprvé izolován z mléčné bílkoviny kasein v roce 1889 a jeho struktura byla objasněna v roce 1902. Lysin je důležitý při vazbě enzymů na koenzymy a hraje důležitou roli ve způsobu, jakým fungují histony. Mnoho obilných plodin má velmi nízký obsah lysinu, což vedlo k jeho nedostatkům u některých populací, které jsou na ně silně závislé jak pro potravu, tak pro potraviny. u vegetariánů a nízkotučných dietářů. V důsledku toho bylo vyvinuto úsilí vyvinout kmeny kukuřice bohaté na lysin.
Met aminokyselina
Methionin byl izolován z mléčné bílkoviny kasein v roce 1922 a byla vyřešena jeho struktura laboratorní syntézou v roce 1928. Methionin je důležitým zdrojem síry pro řadu sloučenin v těle, včetně cysteinu a taurinu. Methionin, spojený s obsahem síry, pomáhá předcházet hromadění tuku v játrech a pomáhá detoxikovat metabolické odpady a toxiny. Methionin je jediná esenciální aminokyselina, která není přítomna ve významném množství sójových bobů, a proto se vyrábí komerčně a přidává se do mnoha výrobky ze sójové moučky.
Aminokyselina Phe
Fenylalanin byl poprvé izolován z přírodního zdroje (klíčky lupiny) v roce 1879 a následně syntetizován chemicky v roce 1882. Lidské tělo je běžně schopno rozložit fenylalanin na tyrosin, avšak u jedinců s dědičným onemocněním fenylketonurií (PKU), enzym, který tuto přeměnu provádí, postrádá aktivitu. Pokud se neléčí, fenylalanin se hromadí v krvi a způsobuje opožděný duševní vývoj u dětí. Z 10 000 dětí se narodí s tímto onemocněním, přijetí diety s nízkým obsahem fenylalaninu v raném věku může zmírnit následky.
Pro aminokyselina
V roce 1900 byl chemicky syntetizován prolin. Následující rok byl izolován z mléčné bílkoviny kasein a jeho struktura se ukázala jako stejná. Lidé mohou syntetizovat prolin z kyseliny glutamové, která se objevuje pouze jako l-stereoizomer v savčích proteinech. Když je prolin začleněn do proteinů, jeho zvláštní struktura vede k ostrým ohybům neboli zlomům v peptidovém řetězci, což výrazně přispívá ke konečné struktuře proteinu. Prolin a jeho derivát hydroxyprolin tvoří 21 % aminokyselinových zbytků vláknitého proteinu kolagenu, který je nezbytný pro pojivovou tkáň.
Ser aminokyselina
Serin byl poprvé izolován z hedvábného proteinu v roce 1865, ale jeho struktura nebyla stanovena do roku 1902. Lidé mohou syntetizovat serin z jiných metabolitů, včetně glycinu, i když v savčích proteinech se objevuje pouze l-stereoizomer. Serin je důležitý pro biosyntézu mnoha metabolitů a je často důležitý pro katalytickou funkci enzymů, do kterých je začleněn, včetně chymotrypsinu a trypsinu. Nervové plyny a některé insekticidy působí spojením se serinovým zbytkem v aktivním místě acetylcholinesterázy, úplně inhibuje enzym. Esterázová aktivita je nezbytná pro rozklad neurotransmiteru acetylcholinu, jinak se hromadí nebezpečně vysoké hladiny, které rychle vedou ke křečím a smrti.
Thr aminokyselina
Threonin byl izolován z fibrinu v roce 1935 a syntetizován ve stejném roce. Pouze l-stereoizomer se vyskytuje v savčích proteinech, kde je relativně nereaktivní. Ačkoli je důležitý v mnoha reakcích bakterií, jeho metabolická role u vyšších živočichů, včetně lidí, zůstává nejasná.
Trp aminokyselina
Izolovaný z kaseinu (mléčný protein) v roce 1901, struktura tryptofanu byla založena v roce 1907 , ale pouze l-stereoisomer se objevuje v savčích proteinech. V lidských střevech bakterie rozkládají tryptofan z potravy a uvolňují sloučeniny jako skatol a indol, které dodávají výkalům jejich nepříjemné aroma. Tryptofan se přeměňuje na vitamín B3 (také nazývaný kyselina nikotinová nebo niacin), ale ne v dostatečné míře, abychom byli zdraví. V důsledku toho musíme také přijímat vitamín B3, pokud tak neučiníme, vede k nedostatku zvanému pelagra.
Aminokyselina Tyr
V roce 1846 byl izolován tyrosin z rozkladu kaseinu (protein ze sýra ), načež byl syntetizován v laboratoři a jeho struktura byla stanovena v roce 1883. Lidé mohou syntetizovat tyrosin z fenylalaninu pouze v l-stereoizomeru v savčích proteinech. Tyrosin je důležitým prekurzorem hormonů nadledvinek epinefrinu a norepinefrinu, hormonů štítné žlázy včetně tyroxinu a pigmentu vlasů a kůže melaninu. V enzymech jsou tyrosinové zbytky často spojeny s aktivními místy, jejichž změna může změnit specificitu enzymu nebo zcela vymazat aktivitu. Pacienti trpící závažným genetickým onemocněním fenylketonurií (PKU) nejsou schopni přeměnit fenylalanin na tyrosin, zatímco pacienti s alkaptonurií mají defektní metabolismus tyrosinu, produkující charakteristickou moč, která na vzduchu ztmavne.
Valná aminokyselina
Struktura valinu byla založena v roce 1906 poté, co byl poprvé izolován z albuminu v roce 1879. V savčí bílkovině se objevuje pouze l-stereoizomer. Valin může být v těle degradován na jednodušší sloučeniny, ale u lidí se vzácným genetickým onemocněním nazývaným onemocnění moči javorovým sirupem vadný enzym přeruší tento proces a může být smrtelný, pokud se neléčí.
Vlastnosti karboxylové skupiny
Vlastnosti hydrofobních aminokyselinVlastnosti polárních aminokyselin
Vlastnosti aromatických aminokyselin
Definice syntézy bílkovin a kód aminokyselin
Za účelem vytvoření proteinu se aminokyseliny polymerují za vytvoření peptidové vazby, začínající na N-konci a končící na C-konci.
Devět esenciálních aminokyselin a aminokyselinové doplňky
Lidské tělo je schopno syntetizovat 11 z 20 aminokyselin, ale zbývajících devět nedokážeme. To je pravděpodobně důsledkem ztráty genu nebo mutace v průběhu času v reakci na měnící se selektivní tlaky, jako je množství určité potraviny obsahující specifické aminokyseliny. Tyto aminokyseliny se proto nazývají esenciální aminokyseliny a musí být přijímány naší stravou. Jednotlivé druhy zvířat jsou schopny syntetizovat různé aminokyseliny a podle toho se liší i jejich dietní požadavky. Lidé jsou například schopni arginin syntetizovat, ale psi a kočky nikoli – musí ho získat příjmem potravy. Na rozdíl od lidí a psů nejsou kočky schopny syntetizovat taurin. To je jeden z důvodů, proč je komerční krmivo pro psy nevhodné pro kočky. Pro člověka je devět aminokyselin, které je nutné získat prostřednictvím stravy, histidin, isoleucin, leucin, lysin, methionin, fenylalanin, threonin, tryptofan a valin.
Potraviny, které obsahují všech devět esenciálních aminokyselin, se označují jako „kompletní bílkoviny“ a zahrnují maso, mořské plody, vejce, mléčné výrobky, sóju, quinou a pohanku. Jiné zdroje bílkovin, jako jsou ořechy, semena, obiloviny a fazole, obsahují některé, ale ne všechny esenciální aminokyseliny, a proto jsou označovány jako neúplné.
Tato tabulka ukazuje v USA doporučené denní dávky devíti esenciálních aminokyselin na 1 kg tělesné hmotnosti.
| Aminokyselina | Doporučené denní dávky (mg/kg tělesné hmotnosti) |
| Histidin | 14 |
| Isoleucin | 19 |
| Leucin | 42 |
| Lyzina | 38 |
| Methionin | 19 |
| Fenylalanin | 33 |
| Threonin | 20 |
| Tryptofan | 5 |
| Valine | 24 |
Pojďme se bavit o doplňcích stravy. Všechny esenciální aminokyselinové potřeby vašeho těla lze uspokojit zdravou a vyváženou stravou. Existují však někteří zastánci užívání doplňků s vysokou koncentrací ke zlepšení faktorů, jako je nálada, spánek, výkon, ztráta hmotnosti a zabránění ztrátě svalové hmoty. Podívejte se na mnoho stránek „zdraví a duševní pohody“ a tam jsou lidé, kteří prodávají výhody aminokyselinových doplňků, ale existují dobré důkazy, které to podporují?
Esenciální aminokyselina tryptofan je nezbytná pro produkci serotoninu, neurotransmiteru, který hraje důležitou roli ve spánku, náladě a chování. V důsledku toho byly v řadě studií zkoumány účinky manipulace s hladinami tryptofanu na spánek a náladu. I když existují důkazy, že snížení hladiny tryptofanu může negativně ovlivnit spánek a náladu, mnoho studií trpí malou velikostí vzorků, nedostatkem dostatečných kontrol nebo jinými nedostatky. V důsledku toho, i když je to jasně klíčová složka ve stravě a může existovat potenciál pro suplementaci mít příznivé účinky, důkazy na podporu podávání tryptofanu nad rámec toho, co lze konzumovat ve zdravé stravě, v současné době chybí a je zapotřebí další výzkum .
I když existují některé studie naznačující, že užívání aminokyselinových doplňků může mít u některých skupin pozitivní účinky na výkon při cvičení, výsledky se mezi jednotlivými studiemi velmi liší a mnoho studií prokazuje malý nebo žádný přínos. Klinická studie také zkoumá důsledky užívání aminokyselinového potravinového doplňku na fotostárnutí pokožky, ale výsledky ještě nebyly zveřejněny.