Les bactéries sont une partie essentielle de l'écosystème. Ils sont essentiels à notre santé et à l'environnement, jouent un rôle important dans la production alimentaire et fournissent aux bioingénieurs des outils pour exploiter leurs propriétés et fabriquer des composés. Cependant, ils peuvent également être nocifs, causant des dommages et des maladies. La capacité de faire croître ces microbes est donc une étape essentielle pour pouvoir utiliser leur pouvoir, identifier les coupables nuisibles et faire progresser notre compréhension et nos capacités. Dans cet article, nous examinons ce qu'est la culture bactérienne, les facteurs affectant les conditions de culture, les problèmes courants et certaines des nombreuses applications.
Qu'est-ce que la culture bactérienne ?
La culture bactérienne est une méthode qui permet la multiplication de cellules bactériennes dans ou sur un milieu de culture dans des conditions de laboratoire contrôlées. Les conditions exactes requises pour une réplication optimale dépendront de l'espèce bactérienne cible.
Culture aérobie vs culture anaérobie
La plupart des bactéries peuvent se développer dans une certaine mesure en présence d'oxygène, connue sous le nom de culture aérobie . Mais pour une croissance optimale, les conditions doivent être ajustées en fonction de la bactérie cible. Les espèces trouvées dans des conditions atmosphériques, comme à la surface de la peau ou dans les voies respiratoires supérieures, se développeront généralement bien en présence d'oxygène. Les espèces qui se trouvent naturellement dans des environnements à faible teneur en oxygène, comme dans les plaies profondes ou les abcès ou l'océan profond, se développeront généralement mieux en l'absence d'oxygène - culture anaérobie . Certains ne peuvent pas du tout se développer en présence d'oxygène, et ceux-ci sont appelés anaérobies obligatoires . Les exemples incluent Fusobacterium et Bacteroides. 1 De même, ceux qui ne peuvent se développer en l'absence d'oxygène sont appelés aérobies obligatoires . Des exemples à des fins de culture comprennent le Gram négatif Pseudomonas aeruginosa 2 et Mycobacterium tuberculosis, 3 l'agent causal de la tuberculose. Cependant, des études suggèrent que les deux peuvent entreprendre une respiration anaérobie dans certaines circonstances. Les bactéries qui peuvent se développer dans des conditions aérobies ou anaérobies, passant de la respiration aérobie à la fermentation ou à la respiration anaérobie en l'absence d'oxygène, sont appelées anaérobies facultatifs . Les exemples incluent les staphylocoques à Gram positif, 4 Escherichia coli (E. coli), 5 Salmonella 6 et Listeria spp.. 7
Méthodes de culture bactérienne
Pour être cultivées avec succès, les bactéries nécessitent l'apport de nutriments dans le milieu de culture. Il existe de nombreuses formulations différentes disponibles pour répondre aux différents besoins nutritionnels des espèces bactériennes. Le type de support que vous choisirez dépendra du but de la culture. Des milieux riches, nutritifs ou complets peuvent être utiles lorsque vous essayez de gonfler une culture pure et d'obtenir des cellules bactériennes en bon état. Les milieux minimaux, en revanche, ne fourniront que le strict nécessaire à la survie et peuvent être utiles pour manipuler les voies activées dans la bactérie.
Les médias peuvent également être classés comme définis ou non définis . Comme son nom l'indique, dans un média défini, tous les ingrédients sont connus. Les milieux non définis ont tendance à contenir des mélanges complexes de nutriments et d'espèces chimiques dans des proportions inconnues, comme l'extrait de levure.
Quel que soit le milieu choisi, celui-ci peut être sous forme liquide sous forme de bouillon de culture, ou de l' agar peut être ajouté pour fixer le milieu et permettre la croissance de cellules bactériennes sur une surface solide.
Bouillon de culture
La culture en milieu liquide, également connue sous le nom de culture en bouillon, donne aux bactéries présentes un accès facile aux nutriments disponibles par rapport aux colonies bactériennes statiques. Une agitation douce pour maintenir les bactéries dispersées dans le milieu pendant l'incubation peut faciliter davantage cet accès. Les milieux liquides dilueront également les déchets au fur et à mesure de leur formation, en les distribuant à travers la culture. Par conséquent, une plus grande masse de bactéries peut être obtenue pour un volume de liquide équivalent par rapport aux milieux solides.
Vous pouvez donc utiliser des cultures en bouillon lorsque vous souhaitez augmenter votre culture, par exemple lorsque vous utilisez des bactéries pour produire un composé souhaitable, dans la production alimentaire ou pour extraire de l'ADN ou des plasmides.
Lorsque vous cherchez à stocker des souches bactériennes à long terme, elles peuvent être cultivées dans des milieux liquides. Du glycérol est ensuite ajouté, ce qui empêchera la congélation complète et la lyse consécutive des cellules bactériennes, permettant leur stockage à -80 °C. Le stockage à long terme de cette manière préserve les souches - utile lors de la collecte de souches sur une longue période - empêche la perte de souches précieuses et réduit également le risque de mutations pouvant survenir à la suite de passages répétés.
Gélose nutritive
L'ajout d'agar dans des milieux liquides permet de le fixer en boîtes de pétri, en pentes ou en bouchons par exemple. Les milieux solides sont utiles lorsque vous souhaitez sélectionner des colonies individuelles à partir d'une culture mixte, par exemple lors de la purification d'un échantillon de diagnostic. Si vous souhaitez dénombrer le nombre d'unités formant colonies (ufc) dans un volume donné d'échantillon liquide, l'ensemencement et l'incubation sur milieu solide le permettent également. L'inoculation sur des pentes ou dans des cultures stab peut également être une méthode pratique pour transporter des souches d'un laboratoire à l'autre sans risque de déversement de matières potentiellement infectieuses.
Milieux sélectifs et différentiels
Il existe également des milieux sélectifs 8 qui favorisent ou suppriment la croissance de certaines espèces, groupes d'espèces ou souches aux propriétés particulières. Cela peut être basé sur la capacité d'une souche à utiliser des nutriments spécifiques, à produire certains sous-produits ou à résister à certains antibiotiques. La sélection peut être utilisée à la fois en bouillon et en milieu solide.
La capacité de la souche à se développer ou non peut être indiquée par des changements de couleur dans les milieux différentiels et est souvent utilisée pour identifier les espèces ou sous-types bactériens. Par exemple, avec les bandelettes de test d'indice de profil analytique (API), les bactéries sont cultivées avec une gamme de substrats, produisant différents modèles de changement de couleur en fonction de leur métabolisme, permettant ainsi l'identification.
Lorsque les souches sont hémolytiques, la croissance sur gélose au sang permet d'évaluer le type d'hémolyse, aidant à identifier les espèces présentes (Figure 1).
Figure 1 : Culture sur gélose au sang montrant une hémolyse alpha (à gauche), bêta (au centre) et gamma (à droite). Crédit : Mibilehre, reproduit sous la licence Creative Commons Attribution-Share Alike 4.0 International.L'ajout d'antibiotiques aux milieux liquides empêchera la croissance de souches non résistantes. Cela peut être utile lors de la culture d'une souche modifiée dans laquelle un gène de résistance aux antibiotiques a été ajouté comme marqueur. La croissance d'espèces ou de colonies contaminantes dans lesquelles l'ingénierie a échoué sera donc contre-sélectionnée.
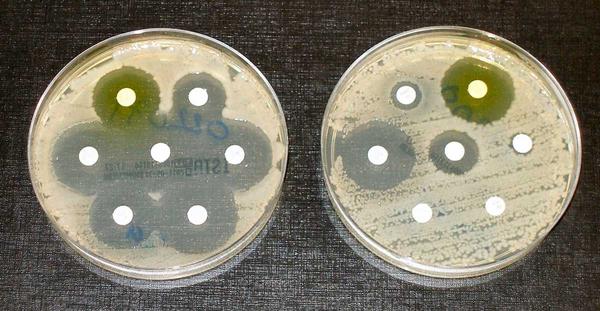
Des antibiotiques peuvent être ajoutés aux milieux solides lors de la préparation, remplissant un rôle similaire à celui des milieux liquides. Alternativement, des disques infusés d'antibiotiques peuvent être placés sur un support solide sur lequel une tache d'intérêt a été inoculée. Lorsque la souche est sensible à l'antibiotique, une zone claire de non croissance sera alors visible autour du disque au fur et à mesure de la croissance du tapis bactérien, permettant par exemple de choisir un antibiotique adapté pour le traitement d'une infection (Figure 2).
Figure 2 : Tests de résistance aux antibiotiques ; les bactéries de la culture de gauche sont sensibles aux antibiotiques contenus dans les disques de papier blanc. Les bactéries de droite sont résistantes à la plupart des antibiotiques. Crédit : Dr Graham Beards, reproduit sous la licence Creative Commons Attribution-Share Alike 4.0 International.Outre les conditions d'oxygène et les besoins en nutriments déjà évoqués, la température et l'humidité auxquelles différentes espèces se développeront de manière optimale varient également, reflétant leur habitat naturel. Les espèces que l'on trouve généralement profondément dans le corps, telles que l'intestin ou les voies respiratoires inférieures, sont susceptibles de mieux se développer à 37 ° C - température corporelle. À l'inverse, les espèces trouvées, par exemple, dans le sol sont susceptibles d'exiger des températures plus fraîches. Lors de manipulations génétiques sur des bactéries, la température peut être utilisée comme interrupteur pour contrôler l'intégration de plasmides sensibles à la température et, par conséquent, favoriser le résultat souhaité.
Courbe de croissance bactérienne
Bien que les taux de division varient entre les espèces bactériennes, ils suivront normalement le même schéma de croissance général dans la culture en bouillon. Le nombre de cellules bactériennes dans une culture peut être estimé par divers moyens, y compris le placage et le comptage des colonies ou en mesurant la turbidité de la culture avec la spectroscopie UV-visible. Lorsque cela est tracé (généralement sur une échelle logarithmique) en fonction du temps, il s'agit d'une courbe de croissance, 9 comme le montre la figure 3.
Figure 3 : Exemple d'une courbe de croissance bactérienne montrant 1) la phase de latence, 2) la phase exponentielle/logarithmique, 3) la phase stationnaire et 4) la phase de mort.1. Phase de latence – Les bactéries s'adaptent à leurs nouvelles conditions de croissance. La durée de cette phase dépendra de la similitude de celles-ci avec leurs conditions antérieures et de l'état des cellules. Les bactéries peuvent avoir besoin de se réparer, de produire des enzymes et de l'ARN pour se répliquer ou de synthétiser des molécules qui manquent à leur environnement.2. Phase exponentielle ou logarithmique - Une fois que les cellules se sont adaptées à leurs conditions et ont les molécules dont elles ont besoin, la division cellulaire commence sérieusement. Cela suit un modèle de doublement prévisible, dont la durée dépendra de l'adéquation des conditions aux espèces bactériennes. Une croissance rapide, et par conséquent une forte pente, se produira là où les conditions sont proches de l'optimum. C'est le point auquel les cellules bactériennes sont les plus saines et donc généralement la phase à partir de laquelle les cellules sont utilisées pour d'autres expériences.3. Phase stationnaire - Les nutriments s'épuisent, les déchets s'accumulent et l'espace peut manquer, ralentissant davantage la division de sorte que le nombre de nouvelles cellules produites soit égal au nombre de morts. Ceci est considéré comme un aplatissement de la courbe de croissance. De nouvelles cellules bactériennes subissent des changements physiologiques pour tenter de s'adapter aux conditions de famine. Pour les espèces productrices de spores, la sporulation peut également commencer.4. Phase de mort ou de déclin - Les conditions ne favorisant plus la croissance, on observe une détérioration constante de l'état des cellules présentes entraînant une baisse de la courbe de croissance. Les cellules non viables peuvent encore contribuer aux mesures de turbidité lorsqu'elles sont utilisées pour estimer le nombre de cellules, en maintenant des valeurs supérieures au nombre de cellules réellement viables. Habituellement, certaines cellules resteront toujours viables car elles mutent ou entrent dans un état dormant pour survivre. Obtention d'une culture pure
Une culture pure est une culture qui ne contient que les espèces bactériennes que vous souhaitez cultiver. La facilité avec laquelle cela peut être réalisé dépendra probablement beaucoup de la source de votre échantillon, de l'abondance de l'espèce cible par rapport aux autres espèces et de l'espèce cible elle-même. Si votre source est une autre culture pure ou une souche qui a été isolée et stockée au congélateur, la culture peut déjà être pure. Si, toutefois, la source est un échantillon clinique ou environnemental, il est probable qu'il y ait de nombreuses autres espèces bactériennes et potentiellement des champignons également présents qui se développeront également avec bonheur dans vos conditions de culture. Des milieux sélectifs et des conditions de croissance restreintes (par exemple, culture aérobie ou anaérobie) peuvent aider à éliminer les espèces non ciblées et à réduire le champ. Le fait de strier l'échantillon sur un milieu solide plutôt que dans un bouillon de culture permettra l'identification visuelle des colonies d'intérêt à partir du contexte général. Il peut être nécessaire de prélever et de re-strier les colonies bactériennes d'intérêt sur des plaques de gélose fraîches à quelques reprises avant qu'une culture pure puisse être obtenue. Une fois que cela est réalisé, ils peuvent ensuite être cultivés en culture liquide si désiré. Si l'espèce cible n'est présente qu'en petit nombre, il peut être nécessaire de strier plusieurs plaques de l'échantillon d'origine afin de les isoler. Certaines espèces poussent plus rapidement et plus vigoureusement que d'autres, c'est donc aussi un facteur à considérer.
Il n'est pas toujours nécessaire d'obtenir une culture pure selon le but de votre expérience. S'il est possible d'identifier l'espèce cible parmi un arrière-plan d'autres espèces et que cela est suffisant pour votre objectif, l'obtention d'une culture pure peut ne pas être nécessaire. Cependant, si vous souhaitez, par exemple, effectuer d'autres tests ciblés ou si les bactéries sont cultivées à des fins de production ou alimentaires, l'obtention et le maintien d'une culture pure peuvent être essentiels.
Problèmes courants avec la culture bactérienne
Applications de la culture bactérienne
Il existe de nombreuses raisons pour lesquelles il peut être nécessaire ou souhaitable de cultiver des cellules bactériennes. Ici, nous considérons certains des objectifs communs.
Diagnostiquer une infection
Malgré le temps nécessaire pour isoler et identifier les espèces bactériennes à partir d'un échantillon, la culture bactérienne reste un outil de diagnostic important. 12 Alors que la PCR peut rapidement identifier la présence d'un agent pathogène spécifique, isoler le coupable confirmera qu'il est vivant, alertant les analystes des risques de transmission potentiels et informant le traitement. Cela signifie également que la souche bactérienne peut être interrogée plus avant pour obtenir des informations telles que la sensibilité aux antibiotiques, orienter les choix de traitement. Les souches peuvent également être stockées pour référence future, par exemple à des fins de surveillance des maladies.
Manipulation génétique
Il peut être souhaitable de manipuler le génome de souches bactériennes pour un certain nombre de raisons ; essayer de comprendre la biologie de base, de l'atténuer lors de la création de souches vaccinales, de surproduire des protéines et de créer une souche de référence avec un marqueur détectable pour n'en citer que quelques-uns. Qu'il s'agisse de mutation, de suppression ou d'insertion de matériel génétique, il existe un besoin fondamental de cultiver la souche d'intérêt 13 avant, pendant et après le processus de génie génétique.
Etude épidémiologique
La culture et la caractérisation des souches bactériennes peuvent être vitales pour les études épidémiologiques. 14 Cela permet aux scientifiques d'étudier comment les populations bactériennes changent au fil du temps - ce qui peut éclairer la conception et les mises à jour thérapeutiques, vaccinales et diagnostiques - et d'étudier les événements de transmission qui peuvent à leur tour éclairer des choses comme la politique et les conseils de santé publique. Le projet de surveillance des isolats gonococciques (GISP) est l'un de ces projets qui surveille les souches pour la résistance aux antibiotiques, aidant à éclairer les recommandations de traitement médicamenteux. Les Centers for Disease Control and Prevention (CDC) gèrent également le système de surveillance Active Bacterial Core (ABC), assurant une surveillance en laboratoire et en population des pathogènes bactériens invasifs d'importance pour la santé publique.
Évoluez pour permettre des études en omique
Alors que le séquençage de l'ADN et de l'ARN peut être effectué avec de minuscules quantités de matériel génétique, même au niveau d'une seule cellule, pour de nombreuses études, le séquençage de nouvelle génération (NGS) est toujours effectué sur du matériel provenant de nombreuses cellules bactériennes et, à ce titre, les bactéries doivent souvent être cultivés avant l'extraction d'ADN ou d'ARN. 15 Si vous êtes intéressé par une souche spécifique (contrairement aux études sur le microbiome qui contiendront un mélange), celle-ci sera probablement dérivée d'une culture pure.
Développer des vaccins et des thérapeutiques
Afin de lutter contre un agent pathogène bactérien, vous devez généralement être en mesure de cultiver également cet agent pathogène. Lors du développement de vaccins, 16 il peut être nécessaire de cultiver des souches pour comprendre leurs génomes, amplifier leurs gènes ou les manipuler. De même, afin de tester des vaccins ou des thérapies candidats, il est souvent nécessaire d'effectuer des expériences de provocation 17 dans lesquelles les individus sont confrontés à l'agent pathogène pour voir si la thérapie est efficace. Pour ce faire, la souche bactérienne est normalement cultivée et, dans un modèle de provocation défini, dénombrée pour contrôler et déterminer la dose que les sujets reçoivent.
Production d'aliments et de boissons
Les bactéries jouent un rôle important dans la production de nombreux aliments et sont largement divisées en probiotiques et cultures starter.
Les probiotiques sont généralement cultivés pour leurs bienfaits pour la santé humaine, 18 souvent par le biais de notre microbiome intestinal. Alors que les probiotiques peuvent contenir de nombreuses espèces bactériennes différentes, Lactobacillus et Bifidobacterium sont des choix courants pour la culture.
Les cultures de départ, d'autre part, sont généralement utilisées dans le cadre d'un processus de production alimentaire, pour développer la saveur, la texture, la valeur nutritionnelle ou améliorer la conservation. Les exemples incluent les pains au levain, le salami, le pepperoni 19 et le jambon séché. Les bactéries lactiques (LAB) se trouvent couramment parmi les cultures starter. Certains aliments et boissons pourraient cependant se situer dans les deux camps, comme le yogourt et le kimchi 20 et le kombucha de plus en plus populaires où les produits sont consommés pour leur saveur ainsi que leurs avantages probiotiques.
Quel que soit l'objectif auquel une culture est destinée, le maintien d'une culture saine et exempte de contaminants est vital pour une production optimale et la sécurité des consommateurs.
Détecter les contaminants alimentaires
Bien que certaines bactéries puissent être souhaitables dans la production alimentaire, elles peuvent également être présentes en tant que contaminant et avoir le potentiel de provoquer de graves maladies d'origine alimentaire. Les causes courantes incluent Salmonella sp., Listeria monocytogenes, Campylobacter jejuni et E. coli. Il est donc important que les analystes soient capables de cultiver toutes les bactéries potentiellement dangereuses à partir d'échantillons alimentaires, même si elles sont présentes en petit nombre.
Références 1. Garrett WS, Onderdonk AB. 249 - Espèces Bacteroides, Prevotella, Porphyromonas et Fusobacterium (et autres bacilles Gram négatif anaérobies médicalement importants). Dans : Bennett JE, Dolin R, Blaser MJ, éds. Principes et pratique des maladies infectieuses de Mandell, Douglas et Bennett (huitième édition). WB Saunders; 2015 :2773-2780. doi:10.1016/B978-1-4557-4801-3.00249-6
2. Crespo A, Pedraz L, Astola J, Torrents E. Pseudomonas aeruginosa présente une formation de biofilm déficiente en l'absence de ribonucléotides réductases de classe II et III en raison d'une croissance anaérobie entravée. Microbiol avant. 2016;7:688. doi:10.3389/fmicb.2016.00688
3. Smith I. Pathogenèse de Mycobacterium tuberculosis et déterminants moléculaires de la virulence. Clin Microbiol Rev. 2003;16(3):463-496. doi:10.1128/CMR.16.3.463-496.2003
4. Harris L, Foster S, Richards R. Une introduction à Staphylococcus aureus et des techniques d'identification et de quantification des adhésines de S. aureus en relation avec l'adhérence aux biomatériaux : examen. eCM. 2002;4:39-60. doi:10.22203/eCM.v004a04
5. von Wulffen J, Sawodny O, Feuer R. Transition d'une culture anaérobie d'Escherichia coli vers l'aérobiose : équilibrer les niveaux d'ARNm et de protéines dans une analyse dynamique de l'équilibre des flux dirigée par la demande. PLoS One. 2016;11(7):e0158711. doi:10.1371/journal.pone.0158711
6. Parkin A, Bowman L, Roessler MM, et al. Comment Salmonella oxyde H2 dans des conditions aérobies. Lettres FEBS. 2012;586(5):536-544. doi:10.1016/j.febslet.2011.07.044
7. Lungu B, Ricke SC, Johnson MG. Croissance, survie, prolifération et pathogenèse de Listeria monocytogenes dans des conditions à faible teneur en oxygène ou anaérobies : une revue. Anaérobe. 2009;15(1-2):7-17. doi:10.1016/j.anaerobe.2008.08.001
8. Bonnet M, Lagier JC, Raoult D, Khelaifia S. Culture bactérienne en conditions sélectives et non sélectives : l'évolution des milieux de culture en microbiologie clinique. Nouveaux Microbes Nouveau Infect. 2020;34:100622. doi:10.1016/j.nmni.2019.100622
9. Maier RM. Chapitre 3 : Croissance bactérienne. Dans : Maier RM, Pepper IL, Gerba CP Environmental Microbiology. Presse académique. 2000 : 37-54. ISBN : 978-0-12-497570-5
10. Bodor A, Bounedjoum N, Vincze GE et al. Défis des bactéries incultivables : perspectives environnementales. Rev Environ Sci Biotechnol 19, 1–22 (2020). doi:10.1007/s11157-020-09522-4
11. Pfyffer GE, Wittwer F. Temps d'incubation des cultures mycobactériennes : Combien de temps est suffisant pour émettre un rapport final négatif au clinicien ? J Clin Microbiol. 2012;50(12):4188-4189. doi:10.1128/JCM.02283-12
12. Giuliano C, Patel CR, Kale-Pradhan PB. Un guide pour l'identification des cultures bactériennes et l'interprétation des résultats. PT. 2019;44(4):192-200. PMC6428495
13. Fels U, Gevaert K, Van Damme P. Génie génétique bactérien au moyen de la recombinaison pour la génétique inverse. De face. Microbiol. 2020;11:2161. doi:10.3389/fmicb.2020.548410
14. Parkhill J, Wren BW. Epidémiologie et biologie bactériennes - enseignements du séquençage du génome. Génome Biol. 2011;12(10):230. doi:10.1186/gb-2011-12-10-230
15. Gautam SS, KC R, Leong KW, Mac Aogáin M, O'Toole RF. Un protocole de débutant étape par étape pour le séquençage du génome entier des pathogènes bactériens humains. Méthodes J Biol. 2019;6(1):e110. doi:10.14440/jbm.2019.276
16. Giesker K, Hensel M. Vaccins bactériens. Dans : Module de référence en sciences biomédicales. Elsevier ; 2014. doi:10.1016/B978-0-12-801238-3.00141-0
17. Osowicki J, Azzopardi KI, Fabri L, et al. Un modèle d'infection humaine contrôlée de la pharyngite à Streptococcus pyogenes (CHIVAS-M75): une étude observationnelle de recherche de dose. Lancette Micro. 2021;2(7):e291-e299. doi:10.1016/S2666-5247(20)30240-8
18. Bazireh H, Shariati P, Azimzadeh Jamalkandi S, Ahmadi A, Boroumand MA. Isolement de nouvelles souches probiotiques de Lactobacillus et Enterococcus à partir de sources salivaires et fécales humaines. Microbiol avant. 2020;11:3064. doi:10.3389/fmicb.2020.597946
19. Yoon JY, Kim D, Kim EB, Lee SK, Lee M, Jang A. Qualité et diversité des bactéries lactiques du salami de porc contenant de la poudre de kimchi. Coréen J Food Sci Anim Resour. 2018;38(5):912-926. doi:10.5851/kosfa.2018.e24
20. Song HS, Whon TW, Kim J, et al. Les niches microbiennes dans les matières premières déterminent l'assemblage de la communauté microbienne pendant la fermentation du kimchi. Chimie alimentaire. 2020;318:126481. doi:10.1016/j.foodchem.2020.126481









